| 1.化学品及び会社情報 | |||
|---|---|---|---|
| 化学品の名称 | 2-アミノ-3-クロロ-1,4-ナフトキノン(別名:キノクラミン(ACN)) | ||
| 化学品の英語名称 | 2-amino-3-chloro-1,4-naphthoquinone | ||
| 製品コード | R03-S-002-MHLW | ||
| 供給者の会社名 | ○○○○株式会社 | ||
| 住所 | 東京都△△区△△町△丁目△△番地 | ||
| 電話番号 | 03-1234-5678 | ||
| ファクシミリ番号 | 03-1234-5678 | ||
| 電子メールアドレス | 連絡先@検セ.or.jp | ||
| 緊急連絡電話番号 | 03-1234-5678 | ||
| 推奨用途及び使用上の制限 | 農薬(除草剤) (NITE-CHRIPより引用) | ||
| 2.危険有害性の要約 | |||
|---|---|---|---|
| GHS分類 | |||
| 分類実施日 (物化危険性及び健康有害性) | ガイダンスVer.2.0 (GHS 6版, JIS Z7252:2019) | ||
| 物理化学的危険性 | - | ||
| 健康に対する有害性 | 急性毒性(経口) | 区分4 | |
| 眼に対する重篤な損傷性/眼刺激性 | 区分2 | ||
| 皮膚感作性 | 区分1A | ||
| 発がん性 | 区分2 | ||
| 生殖毒性 | 区分2 | ||
| 特定標的臓器毒性 (単回ばく露) | 区分3(麻酔作用、気道刺激性) | ||
| 特定標的臓器毒性 (反復ばく露) | 区分1(血液系、肝臓、副腎、泌尿器系) | ||
| 分類実施日 (環境有害性) | ガイダンスVer.2.0 (GHS 6版, JIS Z7252:2019) | ||
| 環境に対する有害性 | 水生環境有害性 短期(急性) | 区分1 | |
| 水生環境有害性 長期(慢性) | 区分1 | ||
| GHSラベル要素 | |||
| 絵表示 |    | ||
| 注意喚起語 | 危険 | ||
| 危険有害性情報 | 飲み込むと有害 強い眼刺激 アレルギー性皮膚反応を起こすおそれ 発がんのおそれの疑い 生殖能又は胎児への悪影響のおそれの疑い 呼吸器への刺激のおそれ 眠気またはめまいのおそれ 長期にわたる、又は反復ばく露による血液系、肝臓、副腎、泌尿器系の障害 長期継続的影響により水生生物に非常に強い毒性 | ||
| 注意書き | |||
| 安全対策 | 使用前に取扱説明書を入手すること。 全ての安全注意を読み理解するまで取り扱わないこと。 粉じん/煙/ガス/ミスト/蒸気/スプレーを吸入しないこと。 粉じん/煙/ガス/ミスト/蒸気/スプレーの吸入を避けること。 取扱い後は手をよく洗うこと。 この製品を使用するときに、飲食又は喫煙をしないこと。 屋外又は換気の良い場所でだけ使用すること。 汚染された作業衣は作業場から出さないこと。 環境への放出を避けること。 保護手袋/保護衣/保護眼鏡/保護面を着用すること。 | ||
| 応急措置 | 吸入した場合:空気の新鮮な場所に移し、呼吸しやすい姿勢で休息させること。 皮膚に付着した場合:多量の水/石けん(鹸)で洗うこと。 皮膚刺激又は発しん(疹)が生じた場合:医師の診察/手当てを受けること。 眼に入った場合:水で数分間注意深く洗うこと。次にコンタクトレンズを着用していて容易に外せる場合は外すこと。その後も洗浄を続けること。 眼の刺激が続く場合:医師の診察/手当てを受けること。 飲み込んだ場合:気分が悪いときは医師に連絡すること。 ばく露又はばく露の懸念がある場合:医師の診察/手当てを受けること。 気分が悪いときは、医師の診察/手当てを受けること。 特別な処置が必要である(このラベルの・・・を見よ)。 注) ”…”は、ラベルに解毒剤等中毒時の情報提供を受けるための連絡先などが記載されている場合のものです。ラベル作成時には、”…”を適切に置き換えてください。 口をすすぐこと。 汚染された衣類を脱ぎ、再使用する場合には洗濯をすること。 漏出物を回収すること。 | ||
| 保管 | 換気の良い場所で保管すること。容器を密閉しておくこと。 施錠して保管すること。 | ||
| 廃棄 | 内容物/容器を都道府県知事の許可を受けた専門の廃棄物処理業者に依頼して廃棄すること。 | ||
| 他の危険有害性 | 情報なし | ||
| 3.組成及び成分情報 | |||
|---|---|---|---|
| 化学物質・混合物の区別 | 化学物質 | ||
| 化学名又は一般名 | 2-アミノ-3-クロロ-1,4-ナフトキノン | ||
| 慣用名又は別名 | キノクラミン(ACN) | ||
| 英語名 | 2-amino-3-chloro-1,4-naphthoquinone Quinoclamine | ||
| 濃度又は濃度範囲 | 情報なし | ||
| 分子式 (分子量) | C10H6ClNO2 (207.61) | ||
| 化学特性 (示性式又は構造式) | 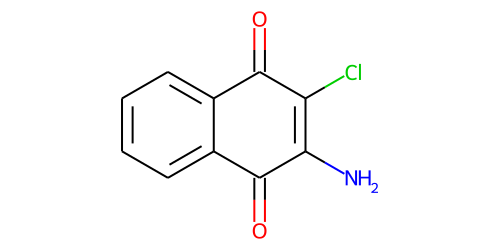 | ||
| CAS番号 | 2797-51-5 | ||
| 官報公示整理番号(化審法) | 4-390 | ||
| 官報公示整理番号(安衛法) | 7-(1)-29、7-(2)-6、7-(2)-7、7-(2)-29 | ||
| GHS分類に寄与する成分(不純物及び安定化添加物も含む) | 情報なし | ||
| 4.応急措置 | |||
|---|---|---|---|
| 吸入した場合 | 空気の新鮮な場所に移し、呼吸しやすい姿勢で休息させること。 ばく露又はばく露の懸念がある場合:医師の診察/手当てを受けること。 気分が悪いときは医師に連絡すること。 気分が悪いときは、医師の診察/手当てを受けること。 | ||
| 皮膚に付着した場合 | 多量の水/石けん(鹸)で洗うこと。 皮膚刺激又は発しん(疹)が生じた場合:医師の診察/手当てを受けること。 特別な処置が必要である(このラベルの・・・を見よ)。 注) ”…”は、ラベルに解毒剤等中毒時の情報提供を受けるための連絡先などが記載されている場合のものです。ラベル作成時には、”…”を適切に置き換えてください。 汚染された衣類を脱ぎ、再使用する場合には洗濯をすること。 | ||
| 眼に入った場合 | 水で数分間注意深く洗うこと。次にコンタクトレンズを着用していて容易に外せる場合は外すこと。その後も洗浄を続けること。 眼の刺激が続く場合:医師の診察/手当てを受けること。 | ||
| 飲み込んだ場合 | 気分が悪いときは医師に連絡すること。 口をすすぐこと。 | ||
| 急性症状及び遅発性症状の最も重要な徴候症状 | 情報なし | ||
| 応急措置をする者の保護に必要な注意事項 | 情報なし | ||
| 医師に対する特別な注意事項 | 情報なし | ||
| 5.火災時の措置 | |||
|---|---|---|---|
| 適切な消火剤 | 小火災:粉末消火剤、二酸化炭素、散水、一般の泡消火剤 大火災:散水、水噴霧、通常の泡消火剤 | ||
| 使ってはならない消火剤 | 棒状注水 | ||
| 火災時の特有の危険有害性 | 火災時に刺激性、腐食性および/または毒性のガスを発生するおそれがある。 | ||
| 特有の消火方法 | 安全にできるのであれば、火災の場所から損傷していない容器を移動する。 消火用水をせき止め、後で廃棄する。 消火後も大量の水を用いて容器を冷却する。 安全弁から音が発生したり、タンクが変色したときは直ちに避難する。 火災に巻き込まれたタンクから常に離れる。 | ||
| 消火を行う者の特別な保護具及び予防措置 | 消火作業の際は、適切な自給式の呼吸器用保護具を着用する。 防火服は、熱に対する防護はするが、化学物質に対しては限定的である。 | ||
| 6.漏出時の措置 | |||
|---|---|---|---|
| 人体に対する注意事項、保護具及び緊急措置 | 適切な呼吸器用保護具を着用する。 漏洩物に触れたり、その中を歩いたりしない。 流出や漏れている場所から、全ての方向に適切な距離をとる。 必要により、風下に適切な隔離距離をとる。 | ||
| 環境に対する注意事項 | 環境汚染を引き起こすことがある。 | ||
| 封じ込め及び浄化の方法及び機材 | 危険でなければ、漏れを止める。 粉じんの発生を防止する。 粉じんの吸入をしない。こぼれたものはプラスチックシートなどで覆い、広がりを最小限に抑える。専門家の監督下を除き清掃や廃棄は行わない。 少量の乾燥固体の漏れ 漏洩物は清浄なシャベルを用いて、清浄な乾燥した容器に入れ、ゆるく覆いをして漏洩場所から移動する。 少量漏洩の場合には、砂、その他の不燃性の吸収剤を用いて集め、容器に入れて後で廃棄する。 大量漏洩の場合には、液体の漏洩物の前方にせきを作り、後で廃棄する。 こぼれた粉末はプラスチックシートで覆い、あるいは飛散しないようにする。 排水溝、下水溝、地下室や閉鎖場所への流入を防ぐ。 | ||
| 二次災害の防止策 | 情報なし | ||
| 7.取扱い及び保管上の注意 | |||
|---|---|---|---|
| 取扱い | |||
| 技術的対策 | 「8. ばく露防止及び保護措置」に記載の措置を行い、必要に応じて保護具を着用する。 | ||
| 安全取扱注意事項 | 使用前に取扱説明書を入手すること。 全ての安全注意を読み理解するまで取り扱わないこと。 粉じん/煙/ガス/ミスト/蒸気/スプレーを吸入しないこと。 屋外又は換気の良い場所でだけ使用すること。 汚染された作業衣は作業場から出さないこと。 環境への放出を避けること。 | ||
| 接触回避 | 「10. 安全性及び反応性」を参照。 | ||
| 衛生対策 | 取扱い後は手をよく洗うこと。 この製品を使用するときに、飲食又は喫煙をしないこと。 | ||
| 保管 | |||
| 安全な保管条件 | 換気の良い場所で保管すること。容器を密閉しておくこと。 施錠して保管すること。 | ||
| 安全な容器包装材料 | 情報なし | ||
| 8.ばく露防止及び保護措置 | ||||
|---|---|---|---|---|
| 許容濃度等については日本産衛学会の「許容濃度の勧告」及びACGHIの「TLVs and BEIs」について記載しています。 | ||||
| 管理濃度 | 未設定 | |||
| 許容濃度等 | ||||
| 日本産衛学会(2021年版) | 未設定 | |||
| ACGIH(2022年版) | 未設定 | |||
| 設備対策 | 情報なし | |||
| 保護具 | ||||
| 呼吸用保護具 | 作業者が粉塵に暴露される場合は呼吸保護具(防じんマスク等)の着用を検討する。 防じんマスクの選択については、以下の点に留意する。 -酸素濃度が18%未満の場所では使用しない。また、有害なガスが存在する場所においては防じんマスクを使用せず、その他の呼吸用保護具の利用を検討すること。 -防じんマスクは、日本工業規格(JIS T8151)に適合した、作業に適した性能及び構造のものを選ぶ。その際、取扱説明書等に記載されているデータを参考にする。 | |||
| 手の保護具 | 保護手袋を着用する。 | |||
| 眼の保護具 | 保護眼鏡を着用する。 | |||
| 皮膚及び身体の保護具 | 保護衣を着用する。 | |||
| 9.物理的及び化学的性質 | |||
|---|---|---|---|
| 物理的状態 | |||
| 物理状態 | 固体 (20℃、1気圧) (GHS判定) | ||
| 色 | 赤色 | ||
| 臭い | データなし | ||
| 融点/凝固点 | 199.0 ℃(PubChem(2022)) | ||
| 沸点、初留点及び沸騰範囲 | データなし | ||
| 可燃性 | データなし | ||
| 爆発下限界及び爆発上限界/可燃限界 | データなし | ||
| 引火点 | データなし | ||
| 自然発火点 | データなし | ||
| 分解温度 | データなし | ||
| pH | データなし | ||
| 動粘性率 | データなし | ||
| 溶解度 | 水に不溶(危険物災害等支援システム(2022)) アセトン、酢酸、ニトロベンゼンに可溶(危険物災害等支援システム(2022)) | ||
| n-オクタノール/水分配係数 | Log Kow: 2.12(PubChem(2022)) | ||
| 蒸気圧 | 4.50X10-7 mmHg(PubChem(2022)) | ||
| 密度及び/又は相対密度 | データなし | ||
| 相対ガス密度 | データなし | ||
| 粒子特性 | データなし | ||
| 10.安定性及び反応性 | |||
|---|---|---|---|
| 反応性 | 「危険有害反応可能性」を参照。 | ||
| 化学的安定性 | 情報なし | ||
| 危険有害反応可能性 | 情報なし | ||
| 避けるべき条件 | 情報なし | ||
| 混触危険物質 | 情報なし | ||
| 危険有害な分解生成物 | 情報なし | ||
| 11.有害性情報 | ||||
|---|---|---|---|---|
| 急性毒性 | ||||
| 経口 | 【分類根拠】 (1)~(4)より、区分4とした。 【根拠データ】 (1)ラット(雄)のLD50:1,360 mg/kg(食安委 農薬評価書 (2013)) (2)ラット(雌)のLD50:1,600 mg/kg(食安委 農薬評価書 (2013)) (3)ラット(雄)のLD50:500 mg/kg(食安委 農薬評価書 (2013)) (4)ラットのLD50:300~2,000 mg/kgの間(CLH Report (2019)) 【参考データ等】 (5)ラット(雌)のLD50:200~500 mg/kgの間(食安委 農薬評価書 (2013)) (6)ラットのLD50:200~500 mg/kgの間(EFSA (2007)) | |||
| 経皮 | 【分類根拠】 (1)、(2)より、区分に該当しない。 【根拠データ】 (1)ラットのLD50:> 5,000 mg/kg(食安委 農薬評価書 (2013)) (2)ラットのLD50:> 2,000 mg/kg(OECD TG 402, GLP)(食安委 農薬評価書 (2013)、EFSA (2007)、CLH Report (2019)) | |||
| 吸入: ガス | 【分類根拠】 GHSの定義における固体であり、区分に該当しない。 | |||
| 吸入: 蒸気 | 【分類根拠】 データ不足のため分類できない。 | |||
| 吸入: 粉じん及びミスト | 【分類根拠】 (1)より、区分を特定できず、分類できない。 【根拠データ】 (1)ラットのLC50(4時間):> 0.79 mg/L(食安委 農薬評価書 (2013)、EFSA (2007)) | |||
| 皮膚腐食性及び皮膚刺激性 | 【分類根拠】 (1)より、区分に該当しない。 【根拠データ】 (1)ウサギ(n=6)を用いた皮膚刺激性試験(GLP、閉塞、4時間適用、168時間観察)において、1時間後に1例で軽度の紅斑がみられたが、24時間後以降に刺激性影響はみられず、残りの5例では皮膚刺激性は全くみられなかったとの報告がある(CLH Report (2019)、農薬工業会:「日本農薬学会誌」第18巻第1号 (1992))。 | |||
| 眼に対する重篤な損傷性又は眼刺激性 | 【分類根拠】 (1)より、区分2とした。 【根拠データ】 (1)ウサギ(n=9)を用いた眼刺激性試験(GLP、14日観察)において、1時間後に非洗眼群6例のうち全例で明らかな結膜発赤及び重度の結膜浮腫がみられ、4例で虹彩炎がみられた。7日後の観察では2例でわずかな領域の角膜混濁が残ったが、14日以内に完全回復した(非洗眼群6例における角膜混濁スコアの平均:0.9、虹彩炎スコアの平均:0.9、結膜発赤スコアの平均:1.8、結膜浮腫スコアの平均:2.1)との報告がある(CLH Report (2019))。 | |||
| 呼吸器感作性 | 【分類根拠】 データ不足のため分類できない。 | |||
| 皮膚感作性 | 【分類根拠】 (1)より、区分1Aとした。 【根拠データ】 (1)モルモット(n=10)を用いたMaximisation試験(OECD TG 406、GLP、皮内投与:1.0%溶液)において、惹起後の陽性率は80%(8/10例)であったとの報告がある(CLH Report (2019))。 | |||
| 生殖細胞変異原性 | 【分類根拠】 (1)~(6)より、区分に該当しない。 【根拠データ】 (1)マウスの骨髄細胞を用いた小核試験(OECD TG474、GLP、単回経口投与)で、陰性の報告がある(食安委 農薬評価書 (2013) 、CLH提案文書 (2019)、農薬工業会:「日本農薬学会誌第18巻第1号」(Accessed Sep. 2020))。 (2)In vivo/in vitro (ex vivo)試験である経口投与後のラットの初代培養肝細胞を用いたUDS試験(OECD TG486、GLP)で、陰性の結果が得られている(食安委 農薬評価書 (2013) 、CLH提案文書 (2019))。 (3)細菌復帰突然変異試験(OECD TG471)で、陰性と報告されている(食安委 農薬評価書 (2013)、CLH提案文書 (2019)、農薬工業会:「日本農薬学会誌第18巻第1号」(Accessed Sep. 2020))。 (4)ほ乳類培養細胞を用いた遺伝子変異試験(OECD TG473)で、陰性との報告がある(食安委 農薬評価書 (2013)、CLH提案文書 (2019)、農薬工業会:「日本農薬学会誌第18巻第1号」(Accessed Sep. 2020))。 (5)ヒトリンパ球を用いた染色体異常試験(OECD TG476)で、陽性(S9+)及び陰性(S9-)(食安委 農薬評価書 (2013)、CLH提案文書 (2019))の結果が得られている。なお、食安委評価書ではヒトリンパを用いた染色体異常試験結果は疑陽性(S9+)及び陰性(S9-)と報告されている。 (6)食品安全委員会では問題となる遺伝毒性は認められなかったとの報告されている(食安委 農薬評価書 (2013)。 【参考データ等】 (7)EUはマウスを用いたin vivo小核試験について、検体が骨髄細胞に到達した(骨髄細胞がばく露された)証拠がなく陰性とは言えない(陰性結果には制限がある)として、本物質ではin vivo試験にデータギャツプがあり、本項は結論を導けない(分類できない)との見解を示している(CLH提案文書 (2019))。 | |||
| 発がん性 | 【分類根拠】 国内外の分類機関による既存分類結果はないが、(1)~(3)よりラットの試験で雌雄に膀胱移行上皮乳頭腫、マウスで雌に悪性リンパ腫の発生増加が疑われている。EUの評価ではラットの試験では膀胱腫瘍以外に副腎の褐色細胞腫の増加も認められるとしている。以上、実験動物種2種で一定程度の発がん性の証拠があるものと考えられたため区分2とした。 【根拠データ】 (1)ラットを用いた2つの2年間慢性毒性試験(混餌投与)のうち、1つは腫瘍性病変の増加は示されなかったが、もう1つでは高用量(676 ppm)投与群で膀胱移行上皮乳頭腫の増加(対照群の雄雌各0/50例に対し、投与群では雄2/50例、雌3/50例)が認められた(食安委 評価書 (2013))。 (2)ラットを用いた2年間混餌投与による発がん性試験では、雌雄とも高用量群のみで膀胱移行上皮乳頭腫の増加がみられた(食安委 評価書 (2013))。CLH Report(2019)では、雌雄の高用量(676 ppm)で膀胱の良性腫瘍(移行上皮乳頭腫)、並びに雌雄の高用量群で副腎の良性腫瘍(褐色細胞腫)の頻度増加が認められたとしている(CLH提案文書 (2019))。 (3)マウスを用いた18ヵ月間混餌投与による発がん性試験では、雌では悪性リンパ腫のPeto検定で正の相関がみられた。対照群との比較では、悪性リンパ腫の発生頻度は低及び高用量投与群で有意な増加がみられたが、中用量群では有意差はなく、用量反応関係が明らかでないことから、検体投与の影響ではないと考えられた(食安委 評価書 (2013))。一方、CLH Report(2019)では、雌の高用量群のみで悪性リンパ腫の増加がみられたとされた。 【参考データ等】 (4)ラットを用いた慢性毒性試験及び発がん性試験において、雌雄で膀胱移行上皮乳頭腫の増加が認められたが、腫瘍の発生機序は遺伝メカニズムによるものとは考え難く、評価に当たり閾値を設定することは可能であると考えられた(食安委 農薬評価書 (2013))。 (5)EUは雌雄ラットでみられた良性腫瘍(膀胱移行上皮の乳頭腫及び副腎の褐色細胞腫)とマウスの雌でみられた悪性リンパ腫の増加に基づき、CLP分類としてカテゴリー2とすることを提案している(CLH提案文書 (2019))。 | |||
| 生殖毒性 | 【分類根拠】 (1)~(4)より、区分2とした。 【根拠データ】 (1)ラットを用いた強制経口投与による発生毒性試験(OECD TG414、GLP、妊娠6~19日)において、75 mg/kg/dayで親動物に体重増加抑制、摂餌量低下、児動物に骨化遅延、低体重、胚胎児死亡率増加がみられたが、催奇形性は認められなかったとの報告がある(食安委 農薬評価書 (2013))。なお、CLH Reportは、親動物に一般毒性影響(体重増加抑制、前肢を漕ぐ、鼻をこする動作、平均子宮重量減少など)、着床前胚損失増加、着床後胚胎児損失増加、早期子宮内胎児死亡数の増加、平均同腹児数の減少、児動物に胎児体重低値、平均同腹重量減少、骨格変異、奇形発生(水腎症3例、皮下浮腫1例、食道後方の動脈弓1例、腎欠損1例)がみられたと報告している(CLH Report (2019))。 (2)ウサギを用いた強制経口投与による発生毒性試験(OECD TG414、GLP、妊娠7~28日)において、17.5 mg/kg/dayで親動物に体重増加抑制、平均同腹児数減少、児動物に奇形発生(水腎症1例、末端尾椎異常の頻度増加)がみられたとの報告がある(CLH Report (2019))。 (3)ウサギを用いた強制経口投与による発生毒性試験(GLP、妊娠7~22日)において、17.5 mg/kg/dayで親動物に体重増加抑制、児動物に着床後後期死胚率増加、平均生存胎児数減少、30 mg/kg/dayで親動物に体重増加抑制、摂餌量低下、児動物に着床後後期死胚率増加、平均生存胎児数減少、胎児死亡率増加がみられたが、催奇形性は認められなかったとの報告がある(食安委 農薬評価書 (2013))。 (4)ウサギを用いた強制経口投与による発生毒性試験(OECD TG414、GLP、妊娠6~18日)において、22.5 mg/kg/dayで親動物に体重増加抑制、児動物に骨化遅延がみられたが、催奇形性は認められられなかったとの報告がある(食安委 農薬評価書 (2013))。なお、CLH Reportは、親動物に体重増加抑制、児動物に骨格変異の頻度増加(尾椎中心数増加)、奇形発生(脊椎側弯症1例、二分脊椎3例、動脈弓異常2例、胸骨分節癒合3例)がみられたと報告している(CLH Report (2019))。 【参考データ等】 (5)ラットを用いた混餌投与による二世代生殖毒性試験において、500 ppmで親動物に体重増加抑制(P雄及びF1雌雄)、児動物に体重増加抑制(F1及びF2)がみられたが、繁殖能に対する影響は認められなかったとの報告がある(食安委 農薬評価書 (2013)、CLH Report (2019)、農薬工業会 (2020))。 (6)EFSAは2007年の報告で本物質の催奇形性影響(ラット:腕頭動脈欠損、動脈弓異常、水腎症、ウサギ:水腎症、腎盂空洞化)を指摘している(EFSA (2007))。 (7)EUは奇形を含む様々な発生影響に基づき、CLP分類として生殖毒性カテゴリー2を提案している(CLH Report (2019))。 | |||
| 特定標的臓器毒性 (単回ばく露) | 【分類根拠】 (1)~(3)より、区分3(麻酔作用)、(4)より、区分3(気道刺激性)が考えられる。よって、区分3(麻酔作用、気道刺激性)とした。 【根拠データ】 (1)ラットを用いた単回経口投与試験において、500mg/kg(区分2の範囲)で死亡例がみられ、軟便または下痢、流涎、嗜眠、立毛、腹臥位、衰弱、呼吸困難、眼瞼閉鎖がみられたとの報告がある(食安委 農薬評価書 (2013))。 (2)ラットを用いた単回経口投与試験(OECD TG423、GLP)において、200mg/kg以上(区分1の範囲)で着色尿、軟便、着色糞、肛門生殖器の汚染がみられ、500mg/kg以上(区分2の範囲)で流涎、嗜眠、立毛、腹臥、被毛粗剛、暗色糞及び消耗衰弱がみられたとの報告がある(CLH Report (2019))。 (3)ラットを用いた単回経口投与試験(OECD TG420、GLP)において、300mg/kg以上(区分1の範囲)で着色尿、軟便、眼瞼下垂が一時的にみられ、2,000mg/kg(区分2の範囲)で不規則呼吸、唾液分泌、嗜眠、自発運動の低下、腹臥がみられたとの報告がある(CLH Report (2019))。 (4)ラットを用いた単回吸入(粉塵)ばく露試験において、0.79 mg/Lで異常姿勢、異常呼吸、ケージ網への鼻や四肢の擦りつけ動作がみられ、これらの症状は刺激性粉じんのばく露に対する反応と一致していると考えられたとの報告がある(CLH Report (2019)、食安委 農薬評価書 (2013))。 | |||
| 特定標的臓器毒性 (反復ばく露) | 【分類根拠】 (1)~(4)より、標的臓器は血液系、肝臓、副腎、泌尿器系(腎臓、膀胱、尿管)と考えられ、区分1の用量範囲で影響がみられていることから、区分1(血液系、肝臓、副腎、泌尿器系)とした。 【根拠データ】 (1)イヌを用いたカプセル投与による90日間経口投与試験において、10 mg/kg/day(区分1の範囲)で血液影響(RBC・Hb・Ht低下、網状赤血球数・網状赤血球比率・血小板容積増加・骨髄造血亢進)、脾臓影響(うっ血・髄外造血亢進、絶対・比重量増加(雄))、肝臓影響(肝類洞細胞内色素沈着・胆管増生)、腎臓影響(腎リポフスチン沈着)、膀胱移行上皮過形成がみられたとの報告がある(食安委 農薬評価書 (2013)、CLH Report (2019))。 (2)イヌを用いた混餌投与による2年間慢性毒性試験において、50 ppm以上(1.4 mg/kg/day(雄)、1.3 mg/kg/day(雌)、区分1の範囲)で血液影響(RBC・Hb・Htの低下、PLTの増加)、肝臓影響(胆管増生・肝クッパー細胞、肝細胞の色素沈着・肝門脈周囲線維化・ASTの増加、ALP増加・類洞拡張・マクロファージ色素沈着・肝細胆管内結石(雌))、副腎影響(皮質細胞空胞変性)、膀胱影響(粘膜細胞色素沈着)がみられ、1,000 ppm(27 mg/kg/day(雄)、31 mg/kg/day(雌)、区分2の範囲)で腎臓影響(腎炎(瘢痕)、尿細管嚢胞化、尿細管拡張(雄))、肝臓影響(ALT・総ビリルビン増加、ALP増加・肝マクロファージ色素沈着・肝細胆管内結石(雄))、胆嚢影響(上皮の過形成、乳頭閉塞)、生殖器影響(精巣重量低下・精子形成減退、精巣萎縮、精巣炎、卵巣周期性低下)、脾臓影響(うっ血、髄外造血(雄)、マクロファージ色素沈着(雌))がみられたとの報告がある(食安委 農薬評価書 (2013)、CLH Report (2019))。 (3)マウスを用いた混餌投与による18ヵ月間経口投与試験において、30 ppm以上(3.82 mg/kg/day(雄)、4.48 mg/kg/day(雌)、区分1の範囲)で副腎褐色萎縮(雌)がみられ、300 ppm(40.2 mg/kg/day(雄)、46.4 mg/kg/day(雌)、区分2の範囲)で心筋線維化(雄)、心、骨格筋及び膀胱血管周囲炎(雌)、肝臓影響(慢性炎症・褐色色素沈着(雌))、腎臓影響(皮質瘢痕、水腎症発現率増加)、胃影響(角化亢進・慢性炎症)がみられたとの報告がある(食安委 農薬評価書 (2013)、CLH Report (2019))。 (4)ラットを用いた混餌投与による2年間慢性毒性/がん原性併合試験において、52 ppm以上(2.82 mg/kg/day(雄)、3.65 mg/kg/day(雌)、区分1の範囲)で腎盂上皮過形成・尿管上皮過形成(雌)がみられ、676 ppm(37.6 mg/kg/day(雄)、49.4 mg/kg/day(雌)、区分2の範囲)で腎臓影響(腎乳頭壊死・腎乳頭限局性壊死(雄))、膀胱影響(漿膜橙色化・上皮過形成)、尿管上皮過形成(雄)、尿道上皮過形成、胃慢性炎症・膵腺房萎縮がみられたとの報告がある(食安委 農薬評価書 (2013)、CLH Report (2012))。 【参考データ等】 (5)ラットを用いた混餌投与による90日間経口投与試験において、200 ppm(14 mg/kg/day(雄)、13 mg/kg/day(雌)、区分2の範囲)で脾臓の絶対・比重量増加及びヘモジデリン沈着、腎臓の絶対・比重量増加及び腎尿細管硝子滴変性(雄)、腎尿細管混濁腫脹(雌)、肝の絶対・比重量増加(雄)、Htの低下(雌)がみられたとの報告がある(食安委 農薬評価書 (2013)、CLH Report (2019))。 (6)ラットを用いた混餌投与による90日間経口投与試験において、300 ppm以上(21 mg/kg/day(雄)、23 mg/kg/day(雌)、区分2の範囲)でHt・Hbの低下(雄)、RBCの低下(雌)、肝絶対・比重量の増加・ALP増加(雄)がみられ、1,500 ppm(114 mg/kg/day(雄)、118 mg/kg/day(雌)、区分に該当しない範囲)でRBCの低下・好中球比率増加(雄)、Ht・Hbの低下・WBC増加(雌)、AST増加、脾臓の絶対・比重量の増加がみられたとの報告がある(食安委 農薬評価書 (2013))。 (7)ラットを用いた混餌投与による90日間経口投与試験において、200 ppm(15.2 mg/kg/day(雄)、19.1 mg/kg/day(雌)、区分2の範囲)で血液影響(RBC・Hb・Ht低下、網状赤血球数・比率増加、APTT延長(雄)など)、脾臓影響(うっ血・髄外造血亢進・色素沈着増加、絶対・比重量増加(雄))、肝臓影響(洞様毛細血管細胞色素沈着、AST増加(雄))、腎臓影響(限局性腎症、色素沈着増加(雌)、尿細管硝子滴変性(雄))、胸腺萎縮がみられたとの報告がある(食安委 農薬評価書 (2013)、CLH Report (2019))。 (8)マウスを用いた混餌投与による90日間経口投与試験において、200 ppm(28 mg/kg/day(雄)、30 mg/kg/day(雌)、区分2の範囲)で肝臓・脾臓のヘモジデリン沈着、精巣絶対・比重量増加がみられたとの報告がある(食安委 農薬評価書 (2013))。 (9)マウスを用いた混餌投与による90日間経口投与試験において、200 ppm(33 mg/kg/day(雄)、46 mg/kg/day(雌)、区分2の範囲)でHtの低下(雌)がみられたとの報告がある(食安委 農薬評価書 (2013))。 (10)ラットを用いた混餌投与による2年間慢性毒性/がん原性併合試験において、500 ppm(23 mg/kg/day(雄)、29 mg/kg/day(雌)、区分2の範囲)で血液影響(好中球比率の増加、RBC・Ht及びリンパ球比率の低下(雌))がみられたとの報告がある(食安委 農薬評価書 (2013))。 (11)ラットを用いた混餌投与による2年間慢性毒性/がん原性併合試験において、676 ppm(38.3 mg/kg/day(雄)、51.5 mg/kg/day(雌)、区分2の範囲)で血液影響(RBC・Hb・Htの低下)、腎臓影響(尿量増加・尿比重低下、腎盂/腎乳頭上皮過形成)、膀胱影響(漿膜橙色化、移行上皮過形成)、尿管(上皮過形成)に組織変化がみられたとの報告がある(食安委 農薬評価書 (2013)、CLH Report (2019))。 | |||
| 誤えん有害性* | 【分類根拠】 データ不足のため分類できない。 | |||
| * JIS Z7252の改訂により吸引性呼吸器有害性から項目名が変更となった。 | ||||
| 12.環境影響情報 | |||
|---|---|---|---|
| 生態毒性 | |||
| 水生環境有害性 短期(急性) | 魚類(ニジマス)96時間LC50 = 0.044 mg/L(EU CLP CLH, 2019)であることから、区分1とした。 | ||
| 水生環境有害性 長期(慢性) | 急速分解性がなく(BIOWIN)、水生植物(コウキクサ)の7日間NOErC = 0.04 mg/L(EU CLP CLH, 2019)から、区分1とした。 | ||
| 残留性・分解性 | 化審法分解度試験:良分解性(化学物質安全性点検結果等(分解性・蓄積性)) | ||
| 生態蓄積性 | 情報なし | ||
| 土壌中の移動性 | 情報なし | ||
| オゾン層への有害性 | 当該物質はモントリオール議定書の附属書に列記されていない。 | ||
| 13.廃棄上の注意 | |||
|---|---|---|---|
| 化学品(残余廃棄物)、当該化学品が付着している汚染容器及び包装の安全で、かつ、環境上望ましい廃棄、又はリサイクルに関する情報 | 廃棄においては、関連法規ならびに地方自治体の基準に従うこと。 都道府県知事などの許可を受けた産業廃棄物処理業者、もしくは地方公共団体がその処理を行っている場合にはそこに委託して処理する。 廃棄物の処理を委託する場合、処理業者等に危険性、有害性を十分告知の上処理を委託する。 | ||
| 容器は洗浄してリサイクルするか、関連法規制並びに地方自治体の基準に従って適切な処分を行う。 空容器を廃棄する場合は、内容物を完全に除去すること。 | |||
| 14.輸送上の注意 | ||||
|---|---|---|---|---|
| 本物質のGHS分類結果に基づく国際規制の分類等は、以下の通りと推定されるが、該否は製品によって異なる場合がある。輸送危険物の分類は、容器等級を含め、荷送人が責任をもって判断することとされているため、輸送の際には、個々の貨物について、製品の状態、形状等も考慮し、輸送モード (航空、船舶) を規制する法規に沿って事業者が判断する必要がある。 | ||||
| 国際規制 | ||||
| 国連番号 | 3077 | |||
| 品名(国連輸送名) | 環境に有害な物質、固体、n.o.s. | |||
| 国連分類 | 9 | |||
| 副次危険 | - | |||
| 容器等級 | - | |||
| 海洋汚染物質 | 該当する | |||
| MARPOL73/78附属書Ⅱ及びIBCコードによるばら積み輸送される液体物質 | 該当しない | |||
| 国内規制 | ||||
| 海上規制情報 | 船舶安全法の規定に従う。 | |||
| 航空規制情報 | 航空法の規定に従う。 | |||
| 陸上規制情報 | 該当しない | |||
| 特別な安全上の対策 | 該当しない | |||
| その他 (一般的) 注意 | 輸送に際しては、直射日光を避け、容器の破損、腐食、漏れのないように積み込み、荷崩れの防止を確実に行う。 重量物を上積みしない。 | |||
| 緊急時応急措置指針番号* | 171 | |||
| * 北米緊急時応急措置指針に基づく。米国運輸省が中心となって発行した「2020 Emengency Response Guidebook (ERG 2020)」(一般社団法人日本化学工業協会によって和訳されている(発行元:日本規格協会)に掲載されている。 | ||||
| 15.適用法令 | ||||
|---|---|---|---|---|
| 法規制情報は作成年月日時点に基づいて記載されております。事業場において記載するに当たっては、最新情報を確認してください。 | ||||
| 労働安全衛生法 | 該当しない | |||
| 化学物質排出把握管理促進法(PRTR法) | 第二種指定化学物質(法第2条第3項、施行令第2条別表第2)(令和5年度分以降の対象) | |||
| 毒物及び劇物取締法 | 該当しない | |||
| 16.その他の情報 | ||||
|---|---|---|---|---|
| 参考文献 | ||||
| 9項、11項については各データ毎に記載。その他の各項については以下を参照。 ・NITE化学物質総合情報提供システム(NITE-CHRIP) ・International Chemical Safety Cards (ICSC) ・Hazardous Substances Data Bank (HSDB) ・GESTIS Substance database (GESTIS) ・ERG 2020版 緊急時応急措置指針-容器イエローカードへの適用 ・一般社団法人日本化学工業協会 編「GHS対応ガイドライン ラベル及び表示・安全デ-タシ-ト作成指針」 | ||||