| 1.化学品等及び会社情報 | |||
|---|---|---|---|
| 化学品の名称 | モネンシンナトリウム (Monensin Sodium Salt) | ||
| 製品コード | R02-B-120 | ||
| 会社名 | ○○○○株式会社 | ||
| 住所 | 東京都△△区△△町△丁目△△番地 | ||
| 電話番号 | 03-1234-5678 | ||
| ファックス番号 | 03-1234-5678 | ||
| 電子メールアドレス | 連絡先@検セ.or.jp | ||
| 緊急連絡電話番号 | 03-1234-5678 | ||
| 推奨用途及び使用上の制限 | 飼料添加物 (NITE-CHRIPより引用) | ||
| 2.危険有害性の要約 | |||
|---|---|---|---|
| GHS分類 | |||
| 分類実施日 (物化危険性及び健康有害性) | R3.3.12、政府向けGHS分類ガイダンス (令和元年度改訂版 (ver2.0)) を使用 | ||
| JIS Z7252:2019準拠 (GHS改訂6版を使用) | |||
| 物理化学的危険性 | - | ||
| 健康に対する有害性 | 急性毒性 (経口) | 区分2 | |
| 急性毒性 (経皮) | 区分3 | ||
| 皮膚感作性 | 区分1B | ||
| 特定標的臓器毒性 (単回ばく露) | 区分1 (骨格筋、心臓) | ||
| 特定標的臓器毒性 (反復ばく露) | 区分1 (心臓、骨格筋、血液系) | ||
| 分類実施日 (環境有害性) | 平成18年度、GHS分類マニュアル(H18.2.10版) | ||
| 環境に対する有害性 | - | ||
| 絵表示 |   | ||
| 注意喚起語 | 危険 | ||
| 危険有害性情報 | 飲み込むと生命に危険 皮膚に接触すると有毒 アレルギー性皮膚反応を起こすおそれ 骨格筋、心臓の障害 長期にわたる、又は反復ばく露による心臓、骨格筋、血液系の障害 | ||
| 注意書き | |||
| 安全対策 | 粉じん/煙/ガス/ミスト/蒸気/スプレーを吸入しないこと。 取扱後はよく手を洗うこと。 この製品を使用するときに、飲食又は喫煙をしないこと。 汚染された作業衣は作業場から出さないこと。 保護手袋/保護衣を着用すること。 | ||
| 応急措置 | ばく露又はばく露の懸念がある場合:医師に連絡すること。 汚染された衣類を直ちに全て脱ぎ、再使用する場合には洗濯をすること。 特別な処置が必要である(このラベルの・・・を見よ)。 注) ”…”は、ラベルに解毒剤等中毒時の情報提供を受けるための連絡先などが記載されている場合のものです。ラベル作成時には、”…”を適切に置き換えてください。 皮膚に付着した場合:多量の水/石けん(鹸)で洗うこと。 皮膚刺激又は発しん(疹)が生じた場合:医師の診察/手当てを受けること。 飲み込んだ場合:直ちに医師に連絡すること。 口をすすぐこと。 | ||
| 保管 | 施錠して保管すること。 | ||
| 廃棄 | 内容物/容器を都道府県知事の許可を受けた専門の廃棄物処理業者に依頼して廃棄すること。 | ||
| 他の危険有害性 | 情報なし | ||
| 3.組成及び成分情報 | |||
|---|---|---|---|
| 単一製品・混合物の区別 | 単一製品 | ||
| 化学名又は一般名 | モネンシンナトリウム | ||
| 別名 | モネンシンモノナトリウム塩 | ||
| ナトリウム=(2S,3R,4S)-4-((2S,5R,7S,8R,9S)-2-{(2S,2'R,3'S,5R,5'R)-2-エチル-5'-[(2S,3S,5R,6R)-6-ヒドロキシ-6-(ヒドロキシメチル)-3,5-ジメチルオキサン-2-イル]-3'-メチル-2,2'-ビオキソラン-5-イル}-9-ヒドロキシ-2,8-ジメチル-1,6-ジオキサスピロ[4.5]デカン-7-イル)-3-メトキシ-2-メチルペンタノアート | |||
| 濃度又は濃度範囲 | 情報なし | ||
| 分子式 (分子量) | C36H61NaO11 (692.9) | ||
| 化学特性 (示性式又は構造式) | 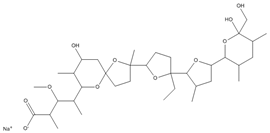 | ||
| CAS番号 | 22373-78-0 | ||
| 官報公示整理番号 (化審法) | 情報なし | ||
| 官報公示整理番号 (安衛法) | 情報なし | ||
| 分類に寄与する不純物及び安定化添加物 | 情報なし | ||
| 4.応急措置 | |||
|---|---|---|---|
| 吸入した場合 | 空気の新鮮な場所に移し、呼吸しやすい姿勢で休息させること。 症状が続く場合には、医師に連絡すること。 | ||
| 皮膚に付着した場合 | 多量の水/石けん(鹸)で洗うこと。 皮膚刺激又は発しん(疹)が生じた場合:医師の診察/手当てを受けること。 | ||
| 眼に入った場合 | 水で数分間注意深く洗うこと。次に、コンタクトレンズを着用していて容易に外せる場合は外すこと。その後も洗浄を続けること。症状が続く場合には、医師に連絡すること。 | ||
| 飲み込んだ場合 | 直ちに医師に連絡すること。 口をすすぐこと。 | ||
| 急性症状及び遅発性症状の最も重要な徴候症状 | 情報なし | ||
| 応急措置をする者の保護 | 情報なし | ||
| 医師に対する特別な注意事項 | 情報なし | ||
| 5.火災時の措置 | |||
|---|---|---|---|
| 適切な消火剤 | 小火災: 粉末消火剤、二酸化炭素、散水 大火災: 粉末消火剤、二酸化炭素、耐アルコール性泡消火剤、散水 | ||
| 使ってはならない消火剤 | 情報なし | ||
| 特有の危険有害性 | 情報なし | ||
| 特有の消火方法 | 情報なし | ||
| 消火を行う者の保護 | 情報なし | ||
| 6.漏出時の措置 | |||
|---|---|---|---|
| 人体に対する注意事項、保護具及び緊急措置 | 保護手袋/保護衣を着用すること。 状況に応じた適切な呼吸用保護具を使用すること。 | ||
| 環境に対する注意事項 | 周辺環境に影響がある可能性があるため、製品の環境中への流出を避ける。 | ||
| 封じ込め及び浄化の方法及び機材 | 飛散した物を掃き集めるか、真空掃除機で吸引する等できるだけ飛散発じんしないようにして、空容器等に回収する。 排水溝、下水溝、地下室あるいは閉鎖場所への流入を防ぐ。 | ||
| 7.取扱い及び保管上の注意 | |||
|---|---|---|---|
| 取扱い | |||
| 技術的対策 | 「8. ばく露防止及び保護措置」に記載の措置を行い、必要に応じて保護具を着用する。 | ||
| 安全取扱い注意事項 | 粉じん/煙/ガス/ミスト/蒸気/スプレーを吸入しないこと。 汚染された作業衣は作業場から出さないこと。 汚染された衣類を直ちに全て脱ぎ、再使用する場合には洗濯をすること。 粉じんを発生させないようにする。 | ||
| 接触回避 | 「10. 安全性及び反応性」を参照。 | ||
| 衛生対策 | この製品を使用する時に、飲食又は喫煙しないこと。 取扱い後はよく手を洗うこと。 | ||
| 保管 | |||
| 安全な保管条件 | 施錠して保管すること。 | ||
| 安全な容器包装材料 | 国連危険物輸送勧告で規定された容器を使用する。 | ||
| 8.ばく露防止及び保護措置 | ||||
|---|---|---|---|---|
| 許容濃度については日本産衛学会の「許容濃度の勧告」及びACGIHの「TLVs and BEIs」について記載しています。 | ||||
| 管理濃度 | 未設定 | |||
| 許容濃度 | ||||
| 日本産衛学会 (2020年度版) | 未設定 | |||
| ACGIH (2020年版) | 未設定 | |||
| 設備対策 | 粉じんが発生する作業所においては、必ず密閉された装置、機器又は局所排気装置を使用する。 | |||
| 保護具 | ||||
| 呼吸用保護具 | 状況に応じた適切な呼吸用保護具を使用すること。 | |||
| 手の保護具 | 保護手袋を着用する。 | |||
| 眼の保護具 | 眼に入るおそれがある場合、保護眼鏡やゴーグルを着用する。 | |||
| 皮膚及び身体の保護具 | 保護衣を着用する。 | |||
| 9.物理的及び化学的性質 | |||
|---|---|---|---|
| 物理的状態 | |||
| 物理状態 | 固体 (20℃、1気圧) (GHS判定) | ||
| 色 | 白色 | ||
| 臭い | データなし | ||
| 融点/凝固点 | 267〜269℃ (毒物劇物取扱いの手引き (2006)) | ||
| 沸点、初留点及び沸騰範囲 | データなし | ||
| 可燃性 | データなし | ||
| 爆発下限界及び爆発上限界/可燃限界 | 該当しない | ||
| 引火点 | 該当しない | ||
| 自然発火点 | 該当しない | ||
| 分解温度 | データなし | ||
| pH | データなし | ||
| 動粘性率 | 該当しない | ||
| 溶解度 | 水: ほとんど溶けない (毒物劇物取扱いの手引き (2006)) クロロホルム、メタノール、エタノールに可溶 (毒物劇物取扱いの手引き (2006)) | ||
| n-オクタノール/水分配係数 | データなし | ||
| 蒸気圧 | データなし | ||
| 密度及び/又は相対密度 | データなし | ||
| 相対ガス密度 | 該当しない | ||
| 粒子特性 | データなし | ||
| 10.安定性及び反応性 | |||
|---|---|---|---|
| 反応性 | 情報なし | ||
| 化学的安定性 | 情報なし | ||
| 危険有害反応可能性 | 情報なし | ||
| 避けるべき条件 | 混触危険物質との接触 | ||
| 混触危険物質 | 強酸化剤 | ||
| 危険有害な分解生成物 | 情報なし | ||
| 11.有害性情報 | |||
|---|---|---|---|
| 急性毒性 | |||
| 経口 | 【分類根拠】 (1)〜(6) より、区分2とした。 【根拠データ】 (1) ラットのLD50 (菌糸体): 雌: 22 mg/kg、雄: 40 mg/kg (食安委 動物用医薬品・飼料添加物評価書 (2015)) (2) ラットのLD50 (菌糸体): 雌: 24 mg/kg (食安委 動物用医薬品・飼料添加物評価書 (2015)) (3) ラットのLD50 (菌糸体): 雌: 205.1 mg/kg、雄: 290.4 mg/kg (食安委 動物用医薬品・飼料添加物評価書 (2015)) (4) ラットのLD50 (結晶): 雌: 238.0 mg/kg、雄: 318.0 mg/kg (食安委 動物用医薬品・飼料添加物評価書 (2015)) (5) ラットのLD50: 21.7〜50 mg/kg (EU EMEA (2007)) (6) ラットのLD50: 雌: 86〜130 mg/kg、雄: 340〜860 mg/kg (EU EFSA (2005)) 【参考データ等】 (7) 感受性は、種間で大きく異なるが、試験に供した全ての動物における毒性徴候は類似しており、死亡、食欲不振、自発運動の低下、骨格筋の筋力低下、歩行失調、下痢及び体重増加抑制であった。総じて、雌は雄より感受性が高かった。毒性影響にモネンシンの形態 (結晶又は菌糸体) による有意な違いはみられなかった (食安委 動物用医薬品・飼料添加物評価書 (2015))。 (8) マウスのLD50 (菌糸体): 雄: 70 mg/kg、雌: 96 mg/kg (食安委 動物用医薬品・飼料添加物評価書 (2015)) (9) マウスのLD50 (菌糸体): 雌: 230.1 mg/kg、雄: 302.0 mg/kg (食安委 動物用医薬品・飼料添加物評価書 (2015)) (10) マウスのLD50 (結晶): 雌: 330.0 mg/kg、雄: 368.0 mg/kg (食安委 動物用医薬品・飼料添加物評価書 (2015)) (11) マウスのLD50 (結晶): 雄: 350.0 mg/kg (食安委 動物用医薬品・飼料添加物評価書 (2015)) | ||
| 経皮 | 【分類根拠】 (1) より、区分3とした。 なお、新たな情報源の使用により、旧分類から分類結果を変更した。 【根拠データ】 (1) ラットのLD50: 雌: 550 mg/kg、雄: 700 mg/kg (EU EFSA (2005)) | ||
| 吸入: ガス | 【分類根拠】 GHSの定義における固体であり、区分に該当しない。 | ||
| 吸入: 蒸気 | 【分類根拠】 データ不足のため分類できない。 | ||
| 吸入: 粉じん及びミスト | 【分類根拠】 データ不足のため分類できない。 | ||
| 皮膚腐食性及び皮膚刺激性 | 【分類根拠】 (1) より、区分に該当しないとした。新しいデータが得られたことから分類結果を変更した。 【根拠データ】 (1) 本物質の原体及び20%調製物のウサギを用いた皮膚刺激性試験で、刺激性はみられていない (EU EFSA (2005))。 【参考データ等】 (2) 菌糸体モネンシン (モネンシン活性 13.4%、本物質として10.6 mg) をウサギ (n=3) の皮膚に 500 mg/kgの用量で単回適用した試験で、1例に軽度の紅斑がみられた以外には刺激性はみられていない (EU EFSA (2004)、HSDB (Access on June 2020))。 (3) モネンシン顆粒 (9.9%調製液) をウサギ (n=3) の皮膚に 2000 mgを24時間閉塞適用した試験で、皮膚には亀裂や硬化がみられ、正常に回復したが、1例が死亡した (EU EFSA (2004))。 | ||
| 眼に対する重篤な損傷性又は眼刺激性 | 【分類根拠】 (1)、(2) より、区分に該当しないとした。 【根拠データ】 (1) 本物質の原体及び20%調製物のウサギを用いた眼刺激性試験で、原体では刺激性はみられなかったが、20%調製物では急性の結膜浮腫及び軽度の結膜発赤がみられ、軽度刺激性と報告されている (EU EFSA (2005))。 (2) 本物質の原体、50%及び10%溶液のウサギを用いた眼刺激性試験で、50%及び10%溶液の刺激性はほとんどない或いは軽微で、原体では軽度の刺激性はみられたが、48時間後には回復した (食安委 動物用医薬品・飼料添加物評価書 (2015))。 【参考データ等】 (3) 菌糸体モネンシン (モネンシン活性 13.4%、本物質として10.6 mg) を適用したウサギ (n=3) を用いた眼刺激性試験で、重度の角膜混濁、虹彩の充血、結膜の炎症と浮腫が24時間以内に観察されたが、これらの反応は治癒することなく、2/3例が死亡した (EU EFSA (2004))。 (4) 乾燥菌糸体モネンシン (59 mg) を適用したウサギ (n=3) を用いた眼刺激性試験で、角膜混濁、著しい虹彩炎、中等度の結膜炎が1時間から観察され、1/3例では7日後に穿孔を伴うブドウ腫、回復に伴い著しい血管新生がみられた (EU EFSA (2004)、JECFA FAS 61 (2009)、食安委 動物用医薬品・飼料添加物評価書 (2015)、HSDB (Access on June 2020))。 (5) 本物質を含む製剤 (53 mg) をウサギに適用した眼刺激性試験で、軽度の角膜混濁、著しい虹彩炎、中等度の結膜炎が適用1時間以内に観察され、適用2時間以内に明らか〜重度の角膜混濁、重度の結膜炎が観察され、角膜混濁は回復しなかった (EU EFSA (2004)、JECFA FAS 61 (2009)、食安委 動物用医薬品・飼料添加物評価書 (2015)、HSDB (Access on June 2020))。 | ||
| 呼吸器感作性 | 【分類根拠】 データ不足のため分類できない。 | ||
| 皮膚感作性 | 【分類根拠】 (1)、(2) より、区分1Bとした。 【根拠データ】 (1) 本物質 (モネンシンとして93.8%) のOECD TG 429に準拠したマウス局所リンパ節試験 (LLNA) で、50 mg/mL (5%) から陽性反応がみられている (EU EFSA (2004)、JECFA FAS 61 (2009))。 (2) 本物質を含む製剤のOECD TG 429に準拠したマウス局所リンパ節試験 (LLNA) で、陽性反応がみられている (EU EFSA (2004))。 【参考データ等】 (3) 本物質の原体及び20%調製物のモルモットを用いた皮膚感作性試験 (マキシマイゼーション法) で、原体及び20%調製物共に感作性陰性と報告されている (EU EFSA (2005))。 (4) 菌糸体モネンシンのモルモットを用いた皮膚感作性試験 (改変ビューラー法) で、感作性は認められなかった (EU EFSA (2004)、JECFA FAS 61 (2009)、食安委 動物用医薬品・飼料添加物評価書 (2015)、HSDB (Access on June 2020))。 | ||
| 生殖細胞変異原性 | 【分類根拠】 (1)、(2) より、区分に該当しないとした。情報を追加し分類を変更した。 【根拠データ】 (1) in vivoでは、経口投与したマウスを用いた小核試験において陰性の報告がある (食安委 動物用医薬品・飼料添加物評価書 (2015)、JECFA FAS 61 (2009)、EU EFSA (2005))。 (2) in vitroでは、細菌の復帰突然変異試験、哺乳類培養細胞を用いる染色体異常試験及び遺伝子突然変異試験において陰性の報告がある (同上)。 | ||
| 発がん性 | 【分類根拠】 国内外の分類機関による既存分類はない。利用可能なヒトを対象とした報告はない。本物質の発がん性試験 (1)、(2) 及び本物質の遊離酸の発がん性試験 (3) のいずれでも投与に関連した腫瘍発生率の増加はみられず、区分に該当しないとした。新たな情報源を用いて検討し分類結果を変更した。 【根拠データ】 (1) 雌雄のラットに本物質を2年間混餌投与した慢性毒性/発がん性併合試験において、悪性及び良性腫瘍が対照群及び投与群に観察されたが、投与と腫瘍の種類及び重症度の間に関連はみられなかった (食安委 動物用医薬品・飼料添加物評価書 (2015))。 (2) モネンシン (CAS番号 17090-79-8) に子宮内ばく露された雌雄ラットに本物質を2年間混餌投与した慢性毒性/発がん性併合試験において、悪性及び良性腫瘍の発生時期及び罹患率には、投与群と対照群の間で違いはみられず、発がん性は認められなかった (食安委 動物用医薬品・飼料添加物評価書 (2015))。 (3) 雌雄のマウスにモネンシン (CAS番号 17090-79-8: 菌糸体) を2年間混餌投与した慢性毒性/発がん性併合試験では、発がん性は認められなかった (食安委 動物用医薬品・飼料添加物評価書 (2015))。 | ||
| 生殖毒性 | 【分類根拠】 本物質のデータ (1)〜(4)、本物質の遊離酸のデータ (5)、(6) を用いて分類した。(1) の本物質によるラットを用いた2世代繁殖試験において、親動物毒性がみられる用量で出生時の同腹児数の低値等がみられたが、(5)、(6) の菌糸体のモネンシン、結晶モネンシンによるラットを用いた3世代繁殖試験で繁殖影響がみられていないことから、この影響は否定されると考えられる。また、(2)〜(4) より胎児の発生に対する影響はないと考えられる。したがって、区分に該当しないとした。 【根拠データ】 (1) 本物質をラットに混餌投与した2世代繁殖試験では、親動物毒性 (体重増加の抑制及び摂餌量低下、雌で授乳中の削痩及び円背位) がみられる用量 (12.5 mg/kg/day) で、出生時の同腹児数及び出生児の体重の低値がみられ、児の体重増加量にも影響がみられた (食安委 動物用医薬品・飼料添加物評価書 (2015))。 (2) 本物質を雌ラットの育成期及び妊娠0〜20日に混餌投与した発生毒性試験において、影響はみられていない (食安委 動物用医薬品・飼料添加物評価書 (2015))。 (3) 本物質を雌ウサギの妊娠6〜18日に強制経口投与した発生毒性試験において、影響はみられていない (食安委 動物用医薬品・飼料添加物評価書 (2015))。 (4) 本物質を雌ウサギの妊娠6〜28日に強制経口投与した発生毒性試験において、母動物毒性 (体重減少、一般状態の悪化、死亡1例、切迫屠殺1例、約半数の母動物で流産) がみられた用量 (3 mg/kg/day) では胎児死亡数の増加がみられた。この用量は、母動物への毒性が高かったことから発生への影響を検討するには適当でないと結論付けられた。母動物毒性がみられない用量 (0.1及び0.3 mg/kg/day) では、胎児に対する影響はみられていない (食安委 動物用医薬品・飼料添加物評価書 (2015))。 (5) 菌糸体のモネンシン (CAS番号 17090-79-8) をラットに混餌投与 (0、1.6、2.5 及び4 mg/kg/day) した3世代繁殖試験では、全投与群の全世代において体重増加量が減少したが、生殖影響、胚毒性、催奇形性はみられていない (食安委 動物用医薬品・飼料添加物評価書 (2015))。 (6) 結晶モネンシンをラットに混餌投与した3世代繁殖試験では、最高用量 (1.43〜2.3 mg/kg/day) まで変化は報告されず、催奇形性もみられていない (食安委 動物用医薬品・飼料添加物評価書 (2015)) | ||
| 特定標的臓器毒性 (単回ばく露) | 【分類根拠】 (1)、(2) より、区分1 (骨格筋、心臓) とした。腎臓への影響は横紋筋融解に伴う二次的影響によるもの考えられるため、不採用とした。また、新たな情報源の使用により、旧分類から分類結果を変更した。 【根拠データ】 (1) 17歳の少年が本物質 (用量不明) と16歳の少年がモネンシン (CAS 17090-79-8) (約500 mg) を摂取した例の2例が報告されている。両症例の初期症状は、吐き気、食欲不振、腹部の痛み等がみられ、さらに、下肢の筋力低下及び激痛、黒褐色の尿、白血球増多症、赤血球沈降速度の亢進がみられた。両症例ともに、本物質による横紋筋融解症が生じて急性腎不全が引き起こされ、1例では心不全が生じた。ヒトにおける本物質の過剰摂取の主な標的は骨格筋及び心筋と考えられたとの記載がある (食安委 動物用医薬品・飼料添加物評価書 (2015))。 (2) 本物質を用いた単回経口投与試験において、ラット、マウス、イヌ、サルなどの動物種間で感受性は大きく異なるが、試験に供した全ての動物における毒性徴候は類似しており、死亡、食欲不振、自発運動の低下、骨格筋の筋力低下、歩行失調、下痢及び体重増加抑制であった。雌は雄より感受性が高かった。毒性影響にモネンシンの形態 (結晶又は菌糸体) による有意な違いはみられなかった (食安委 動物用医薬品・飼料添加物評価書 (2015)、EU EMEA (2007))。なお、経口投与におけるラット及びマウスの最小のLD50値はラットで22〜40 mg/kg、マウスで70〜96 mg/kgであり (食安委 動物用医薬品・飼料添加物評価書 (2015))、上記の症状は区分1の用量範囲で生じるものと考えられた。 【参考データ等】 (3) 17歳の男性がモネンシンの複合製剤 (プレミックス) を故意に摂取した後に、腎不全を伴う急性横紋筋融解症で死亡した (EU EMEA (2007))。 (4) モネンシンを摂取した患者は、重篤な横紋筋融解症となり、さらに急性腎不全や心不全を併発し、死亡した (HSDB (Access on June 2020))。 | ||
|---|---|---|---|
| 特定標的臓器毒性 (反復ばく露) | 【分類根拠】 (1)〜(4) より、区分1 (心臓、骨格筋、血液系) とした。新たな情報を用いて検討した結果、旧分類から分類結果を変更した。 【根拠データ】 (1) マウスに本物質 (菌糸体) を3ヵ月間混餌投与した結果、5.6 mg/kg/day (区分1の範囲) の雄1例で心筋線維の軽度のび漫性空胞化が、5.6 mg/kg/day (区分1の範囲) 以上の雌で白血球数減少が、11.2 mg/kg/day (区分2の範囲) の雄で白血球数及びリンパ球百分率の低下、好中球の増加が、22.5 mg/kg/day (区分2の範囲) 以上の雌雄で赤血球数、ヘモグロビン、ヘマトクリット値の低下、雄で血清CPKの上昇が、45 mg/kg/day (区分2の範囲) の雌雄 (雄8例、雌2例) で心筋線維の軽度のび漫性空胞化、雌で血清CPKの上昇がみられた (食安委 動物用医薬品・飼料添加物評価書 (2015))。 (2) ラットに本物質 (菌糸体) を90日間混餌投与した結果、500 ppm (39〜47 mg/kg/day、区分2の範囲) の雌雄で死亡 (雄40%、雌80%)、摂餌量及び食餌効率の低下、骨格筋の筋炎、び漫性の変性及び組織球の浸潤を伴う心筋の変化、横隔膜筋線維の変性が、雄でヘマトクリット値、白血球数の減少がみられた (同群の雌については生存数が少なく統計解析を行えず) (食安委 動物用医薬品・飼料添加物評価書 (2015))。 (3) イヌに本物質 (菌糸体) を90日間経口投与した結果、15 mg/kg/day (区分2の範囲) 以上の雄でと殺及び死亡 (15 mg/kg/day群で1例と殺、50 mg/kg/day群で2例死亡、死亡例で筋線維の変性、マクロファージの浸潤及び内臓のうっ血を伴った心筋障害)、嘔吐、体重低下、筋力低下、運動失調、不整脈、痙攣及び散瞳、筋線維のび漫性変性や組織球の浸潤等の横紋筋の変化等が、50 mg/kg/day (区分2の範囲) の雌で筋線維のび漫性変性や組織球の浸潤等の横紋筋の変化がみられた (食安委 動物用医薬品・飼料添加物評価書 (2015))。 (4) イヌに本物質を13週間混餌投与した結果、83 ppm (2.1 mg/kg/day、区分1の範囲) 以上の雌雄で筋変性の所見が、167 ppm (4.2 mg/kg/day、区分1の範囲) の雌で投与11日後に活動低下 (投与18日後まで投与を中止した結果、回復)、250 ppm (6.3 mg/kg/day、区分1の範囲) の雌雄で活動低下及び運動失調がみられた (食安委 動物用医薬品・飼料添加物評価書 (2015))。 【参考データ等】 (5) ラットに本物質を52週間混餌投与した結果、1.36 mg/kg/dayの雌で肝細胞の空胞化 (リポ蛋白の蓄積) が、4.59 mg/kg/dayの雌1例で死亡がみられたとの報告がある (食安委 動物用医薬品・飼料添加物評価書 (2015))。 (6) 本物質 (結晶) を用いた2件のラット2年間慢性毒性/発がん性併合試験の結果、一過性の体重減少を除いては投与による影響はみられなかったと報告されている (食安委 動物用医薬品・飼料添加物評価書 (2015))。 | ||
|---|---|---|---|
| 誤えん有害性* | 【分類根拠】 データ不足のため分類できない。 | |||
|---|---|---|---|---|
| * JIS Z7252の改訂により吸引性呼吸器有害性から項目名が変更となった。本有害性項目の内容に変更はない。 | ||||
| 12.環境影響情報 | |||
|---|---|---|---|
| 生態毒性 | |||
| 水生環境有害性 (急性) | データがなく分類できない。 | ||
| 水生環境有害性 (長期間) | データがなく分類できない。 | ||
| オゾン層への有害性 | - | ||
| 13.廃棄上の注意 | |||
|---|---|---|---|
| 残余廃棄物 | 廃棄においては、関連法規並びに地方自治体の基準に従うこと。 都道府県知事などの許可を受けた産業廃棄物処理業者、もしくは地方公共団体がその処理を行っている場合にはそこに委託して処理する。 廃棄物の処理を委託する場合、処理業者等に危険性、有害性を十分告知の上処理を委託する。 | ||
| 汚染容器及び包装 | 容器は洗浄してリサイクルするか、関連法規制並びに地方自治体の基準に従って適切な処分を行う。 空容器を廃棄する場合は、内容物を完全に除去すること。 | ||
| 14.輸送上の注意 | ||||
|---|---|---|---|---|
| 本物質のGHS分類結果に基づく国際規制の分類等は、以下の通りと推定されるが、該否は製品によって異なる場合がある。輸送危険物の分類は、容器等級を含め、荷送人が責任をもって判断することとされているため、輸送の際には、個々の貨物について、製品の状態、形状等も考慮し、輸送モード (航空、船舶) を規制する法規に沿って事業者が判断する必要がある。 | ||||
| 国際規制 | ||||
| 国連番号 | 3462 | |||
| 国連品名 | TOXINS, EXTRACTED FROM LIVING SOURCES, SOLID,N.O.S. | |||
| 国連危険有害性クラス | 6.1 | |||
| 副次危険 | - | |||
| 容器等級 | II | |||
| 海洋汚染物質 | - | |||
| MARPOL73/78附属書賖及びIBCコードによるばら積み輸送される液体物質 | - | |||
| 国内規制 | ||||
| 海上規制情報 | 船舶安全法の規定に従う。 | |||
| 航空規制情報 | 航空法の規定に従う。 | |||
| 陸上規制情報 | 毒物及び劇物取締法、道路法の規定に従う。 | |||
| 特別な安全上の対策 | 毒物及び劇物取締法、道路法の規定によるイエローカード携行の対象物 | |||
| その他 (一般的) 注意 | 輸送に際しては、直射日光を避け、容器の破損、腐食、漏れのないように積み込み、荷崩れの防止を確実に行う。 重量物を上積みしない。 | |||
| 緊急時応急措置指針番号* | 153 | |||
| * 北米緊急時応急措置指針に基づく。米国運輸省が中心となって発行した「2016 Emengency Response Guidebook (ERG 2016)」(一般社団法人日本化学工業協会によって和訳されている(発行元:日本規格協会)に掲載されている。 | ||||
| 15.適用法令 | ||||
|---|---|---|---|---|
| 法規制情報は作成年月日時点に基づいて記載されております。事業場において記載するに当たっては、最新情報を確認してください。 | ||||
| 労働安全衛生法 | - | |||
| 化学物質排出把握管理促進法 (PRTR法) | - | |||
| 毒物及び劇物取締法 | 劇物(指定令第2条)【100の18 モネンシン、その塩類及びこれらのいずれかを含有する製剤】 | |||
| 道路法 | 車両の通行の制限(施行令第19条の13、(独)日本高速道路保有・債務返済機構公示第12号・別表第2)【3 モネンシン、その塩類及びこれらのいずれかを含有する製剤】 | |||
| 航空法 | 毒物類・毒物(施行規則第194条危険物告示別表第1)【【国連番号】3462 トキシン類(固体)(生体から抽出されたもの)】 | |||
| 船舶安全法 | 毒物類・毒物(危規則第3条危険物告示別表第1)【【国連番号】3462 トキシン類(固体)(生体から抽出されたもの)】 | |||
| 港則法 | その他の危険物・毒物類(毒物)(法第21条第2項、規則第12条、危険物の種類を定める告示別表)【2チ トキシン類(固体)(生体から抽出されたもの)】 | |||
| 16.その他の情報 | ||||
|---|---|---|---|---|
| 参考文献 | ||||
| 9項、11項については各データ毎に記載。その他の各項については以下を参照。 NITE化学物質総合情報提供システム (NITE-CHRIP) International Chemical Safety Cards (ICSC) Hazardous Substances Data Bank (HSDB) GESTIS Substance database (GESTIS) ERG 2016版 緊急時応急措置指針−容器イエローカードへの適用 | ||||