| 1.化学品及び会社情報 | |||
|---|---|---|---|
| 化学品の名称 | パラ-ニトロクロロベンゼン | ||
| 化学品の英語名称 | p-Nitrochlorobenzene | ||
| 製品コード | R03-B-013-MHLW | ||
| 供給者の会社名 | ○○○○株式会社 | ||
| 住所 | 東京都△△区△△町△丁目△△番地 | ||
| 電話番号 | 03-1234-5678 | ||
| ファクシミリ番号 | 03-1234-5678 | ||
| 電子メールアドレス | 連絡先@検セ.or.jp | ||
| 緊急連絡電話番号 | 03-1234-5678 | ||
| 推奨用途及び使用上の制限 | アゾ染料・硫化染料・医薬中間体/アゾ染料中間体 (NITE-CHRIPより引用) | ||
| 2.危険有害性の要約 | |||
|---|---|---|---|
| GHS分類 | |||
| 分類実施日 (物化危険性及び健康有害性) | R4.3.15、政府向けGHS分類ガイダンス(令和元年度改訂版(Ver2.0))を使用 | ||
| 物理化学的危険性 | 自己反応性化学品 | タイプG | |
| 健康に対する有害性 | 急性毒性(経口) | 区分4 | |
| 急性毒性(経皮) | 区分3 | ||
| 生殖細胞変異原性 | 区分2 | ||
| 発がん性 | 区分1B | ||
| 生殖毒性 | 区分1B | ||
| 特定標的臓器毒性 (単回ばく露) | 区分1(血液系) | ||
| 特定標的臓器毒性 (反復ばく露) | 区分1(血液系) | ||
| 分類実施日 (環境有害性) | ガイダンス(H21.3版) (GHS 2版, JIS Z 7252:2009) | ||
| 環境に対する有害性 | 水生環境有害性 短期(急性) | 区分2 | |
| 水生環境有害性 長期(慢性) | 区分2 | ||
| GHSラベル要素 | |||
| 絵表示 |    | ||
| 注意喚起語 | 危険 | ||
| 危険有害性情報 | 飲み込むと有害 遺伝性疾患のおそれの疑い 発がんのおそれ 生殖能又は胎児への悪影響のおそれ 血液系の障害 長期にわたる、又は反復ばく露による血液系の障害 長期継続的影響により水生生物に毒性 | ||
| 注意書き | |||
| 安全対策 | 使用前に取扱説明書を入手すること。 全ての安全注意を読み理解するまで取り扱わないこと。 粉じん/煙/ガス/ミスト/蒸気/スプレーを吸入しないこと。 取扱い後は手をよく洗うこと。 この製品を使用するときに、飲食又は喫煙をしないこと。 環境への放出を避けること。 保護手袋/保護衣/保護眼鏡/保護面を着用すること。 | ||
| 応急措置 | 皮膚に付着した場合:多量の水/石けん(鹸)で洗うこと。 飲み込んだ場合:気分が悪いときは医師に連絡すること。 ばく露又はばく露の懸念がある場合:医師に連絡すること。 ばく露又はばく露の懸念がある場合:医師の診察/手当てを受けること。 気分が悪いときは、医師の診察/手当てを受けること。 特別な処置が必要である(このラベルの・・・を見よ)。 注) ”…”は、ラベルに解毒剤等中毒時の情報提供を受けるための連絡先などが記載されている場合のものです。ラベル作成時には、”…”を適切に置き換えてください。 口をすすぐこと。 汚染された衣類を直ちに全て脱ぎ、再使用する場合には洗濯をすること。 漏出物を回収すること。 | ||
| 保管 | 施錠して保管すること。 | ||
| 廃棄 | 内容物/容器を都道府県知事の許可を受けた専門の廃棄物処理業者に依頼して廃棄すること。 | ||
| 他の危険有害性 | 情報なし | ||
| 3.組成及び成分情報 | |||
|---|---|---|---|
| 化学物質・混合物の区別 | 化学物質 | ||
| 化学名又は一般名 | パラ-ニトロクロロベンゼン | ||
| 慣用名又は別名 | p-クロロニトロベンゼン 1-クロロ-4-ニトロベンゼン | ||
| 英語名 | p-Nitrochlorobenzene p-Chloronitrobenzene 1-Chloro-4-nitrobenzene Benzene, 1-chloro-4-nitro- | ||
| 濃度又は濃度範囲 | 情報なし | ||
| 分子式 (分子量) | C6H4ClNO2 (157.56) | ||
| 化学特性 (示性式又は構造式) | 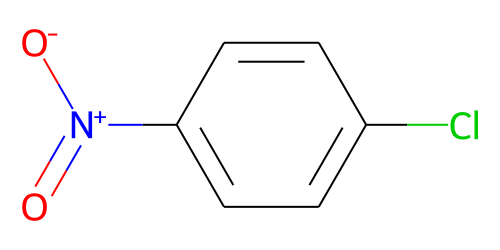 | ||
| CAS番号 | 100-00-5 | ||
| 官報公示整理番号(化審法) | 3-442 | ||
| 官報公示整理番号(安衛法) | 情報なし | ||
| GHS分類に寄与する成分(不純物及び安定化添加物も含む) | 情報なし | ||
| 4.応急措置 | |||
|---|---|---|---|
| 吸入した場合 | 医師の診察/手当てを受けること。 医師に連絡すること。 気分が悪いときは、医師の診察/手当てを受けること。 | ||
| 皮膚に付着した場合 | 多量の水/石けん(鹸)で洗うこと。 特別な処置が必要である(このラベルの・・・を見よ)。 注) ”…”は、ラベルに解毒剤等中毒時の情報提供を受けるための連絡先などが記載されている場合のものです。ラベル作成時には、”…”を適切に置き換えてください。 汚染された衣類を直ちに全て脱ぎ、再使用する場合には洗濯をすること。 | ||
| 眼に入った場合 | 数分間多量の水で洗い流し(できればコンタクトレンズをはずして)、医療機関に連絡する。 | ||
| 飲み込んだ場合 | 気分が悪いときは医師に連絡すること。 口をすすぐこと。 | ||
| 急性症状及び遅発性症状の最も重要な徴候症状 | 吸入:紫色(チアノーゼ)の唇や爪、めまい、頭痛、吐き気、嘔吐、脱力感。 皮膚:紫色(チアノーゼ)の唇や爪、めまい、頭痛、吐き気、嘔吐、脱力感。 経口摂取 : 紫色(チアノーゼ)の唇や爪、めまい、頭痛、吐き気、嘔吐、脱力感。 血液に影響を与える、メトヘモグロビンを生成することがある。皮膚感作を引き起こすことがある。 | ||
| 応急措置をする者の保護に必要な注意事項 | 情報なし | ||
| 医師に対する特別な注意事項 | 情報なし | ||
| 5.火災時の措置 | |||
|---|---|---|---|
| 適切な消火剤 | 水噴霧、粉末消火薬剤、泡消火薬剤、二酸化炭素 | ||
| 使ってはならない消火剤 | 情報なし | ||
| 火災時の特有の危険有害性 | 窒素酸化物、塩化水素、ホスゲンおよび塩素の、有毒なガスを生じる。 熱、火花及び火炎で発火するおそれがある。 火災に巻き込まれると、燃焼を加速する。 加熱されたり、火災に巻き込まれると、爆発的に分解するおそれがある。 | ||
| 特有の消火方法 | 危険でなければ火災区域から容器を移動する。 安全に対処できるならば着火源を除去すること。 | ||
| 消火を行う者の特別な保護具及び予防措置 | 消火作業の際は、適切な自給式の呼吸器用保護具、防護服(耐熱性)を着用する。 | ||
| 6.漏出時の措置 | |||
|---|---|---|---|
| 人体に対する注意事項、保護具及び緊急措置 | 全ての着火源を取り除く。 直ちに、全ての方向に適切な距離を漏洩区域として隔離する。 関係者以外の立入りを禁止する。 密閉された場所に立入る前に換気する。 | ||
| 環境に対する注意事項 | 環境中に放出してはならない。 漏出物を回収すること。 | ||
| 封じ込め及び浄化の方法及び機材 | こぼれた物質を、ふた付きの 密閉式容器内に掃き入れる 湿らせてもよい場合は、粉塵を避けるために湿らせてから掃き入れる 残留分を、注意深く集める 地域規則に従って保管・処理する おがくずや、可燃性吸収剤に吸収させてはならない | ||
| 二次災害の防止策 | 情報なし | ||
| 7.取扱い及び保管上の注意 | |||
|---|---|---|---|
| 取扱い | |||
| 技術的対策 | 「8. ばく露防止及び保護措置」に記載の措置を行い、必要に応じて保護具を着用する。 | ||
| 安全取扱注意事項 | 使用前に取扱説明書を入手すること。 全ての安全注意を読み理解するまで取り扱わないこと。 粉じん/煙/ガス/ミスト/蒸気/スプレーを吸入しないこと。 | ||
| 接触回避 | 「10. 安全性及び反応性」を参照。 | ||
| 衛生対策 | 取扱い後は手をよく洗うこと。 この製品を使用するときに、飲食又は喫煙をしないこと。 | ||
| 保管 | |||
| 安全な保管条件 | 施錠して保管すること。 | ||
| 安全な容器包装材料 | 国連危険物輸送勧告モデル規則で規定されている容器を使用する。 | ||
| 8.ばく露防止及び保護措置 | ||||
|---|---|---|---|---|
| 許容濃度等については日本産衛学会の「許容濃度の勧告」及びACGHIの「TLVs and BEIs」について記載しています。 | ||||
| 管理濃度 | 0.6 mg/m3 | |||
| 許容濃度等 | ||||
| 日本産衛学会(2021年版) | 許容濃度: 0.1 ppm、0.64 mg/m3(皮) | |||
| ACGIH(2022年版) | TLV-TWA: 0.1 ppm(Skin) | |||
| 設備対策 | 取り扱いの場所の近くに、洗眼及び身体洗浄のための設備を設ける。 作業場では全体換気を行う。 設備は可能であれば密閉系とし局所排気装置を用いる。 | |||
| 保護具 | ||||
| 呼吸用保護具 | 作業者が粉塵に暴露される場合は呼吸保護具(防じんマスク等)の着用を検討する。 防じんマスクの選択については、以下の点に留意する。 -酸素濃度が18%未満の場所では使用しない。また、有害なガスが存在する場所においては防じんマスクを使用せず、その他の呼吸用保護具の利用を検討すること。 -防じんマスクは、日本工業規格(JIS T8151)に適合した、作業に適した性能及び構造のものを選ぶ。その際、取扱説明書等に記載されているデータを参考にする。 | |||
| 手の保護具 | 保護手袋を着用する。 不浸透性手袋の使用を検討すること。 | |||
| 眼の保護具 | 保護眼鏡を着用する。 | |||
| 皮膚及び身体の保護具 | 保護衣を着用する。 | |||
| 9.物理的及び化学的性質 | |||
|---|---|---|---|
| 物理的状態 | |||
| 物理状態 | 固体 (20℃、1気圧) (GHS判定) | ||
| 色 | 緑色を帯びた黄色 | ||
| 臭い | 強い特徴のある芳香臭 | ||
| 融点/凝固点 | 83 ℃(GESTIS(2021)) 82~84 ℃(ICSC(1997)) 82.2 ℃(CRC(2018)) | ||
| 沸点、初留点及び沸騰範囲 | 242 ℃(GESTIS(2021)) 238 ℃(CRC(2018)) | ||
| 可燃性 | 可燃性(ICSC(1997)) | ||
| 爆発下限界及び爆発上限界/可燃限界 | データなし | ||
| 引火点 | 127 ℃(Closed cup)(GESTIS(2021)) 110 ℃(SAX(2000)) | ||
| 自然発火点 | 510 ℃(Hommel(1996)) | ||
| 分解温度 | 360~380 ℃(GESTIS(2021)) | ||
| pH | データなし | ||
| 動粘性率 | データなし | ||
| 溶解度 | 水: 225 mg/L(20℃)(GESTIS(2021)) 水: <0.1 mg/mL(75°F)(CAMEO(2021)) アルコール、二硫化炭素、エーテルに可溶(SAX(2000)) | ||
| n-オクタノール/水分配係数 | Log Kow: 2.39(GESTIS(2021)、ICSC(1997)) | ||
| 蒸気圧 | 20 Pa(30℃)(ICSC(1997)) 16 (20℃)(Hommel(1996)) 0.21 kPa(25℃)(化学物質安全性データブック(1997)) | ||
| 密度及び/又は相対密度 | 1.37 g/cm3(20℃)(GESTIS(2021)) 1.2979 g/cm3(CRC(2018) ) | ||
| 相対ガス密度 | 5.44 (空気=1)(ICSC(1997)) | ||
| 粒子特性 | データなし | ||
| 10.安定性及び反応性 | |||
|---|---|---|---|
| 反応性 | 「危険有害反応可能性」を参照。 | ||
| 化学的安定性 | 法規制に従った保管及び取扱においては安定と考えられる。 | ||
| 危険有害反応可能性 | 可燃性。加熱すると分解し、有毒なガス(窒素酸化物、塩化水素、ホスゲン、塩素)を生じる。強酸化剤で、還元性物質と激しく反応する。 | ||
| 避けるべき条件 | 熱 | ||
| 混触危険物質 | 還元性物質 | ||
| 危険有害な分解生成物 | 窒素酸化物、塩化水素、ホスゲン、塩素 | ||
| 11.有害性情報 | ||||
|---|---|---|---|---|
| 急性毒性 | ||||
| 経口 | 【分類根拠】 (1)~(9)より、(1)の知見が区分3上限付近であること、その他の知見が区分4範囲であることから総合的に判断し、区分4とした。 【根拠データ】 (1)ラット(雄)のLD50:294 mg/kg(SIAR (2002)、AICIS IMAP (2016)) (2)ラット(雌)のLD50:565 mg/kg(SIAR (2002)、AICIS IMAP (2016)) (3)ラット(雄)のLD50:694 mg/kg(SIAR (2002)) (4)ラット(雌)のLD50:664 mg/kg(SIAR (2002)) (5)ラットのLD50:530 mg/kg(ACGIH (7th, 2001)) (6)ラットのLD50:420 mg/kg(DFG MAK (1992)、厚労省委託がん原性試験結果 (1991)) (7)ラットのLD50:650 mg/kg(厚労省委託がん原性試験結果 (1991)) (8)ラット(雄)のLD50:860 mg/kg(厚労省委託がん原性試験結果 (1991)) (9)ラット(雌)のLD50:680 mg/kg(厚労省委託がん原性試験結果 (1991)) | |||
| 経皮 | 【分類根拠】 (1)~(7)より、有害性の高い区分を採用し、区分3とした。 【根拠データ】 (1)ラット(雄)のLD50:750 mg/kg(SIAR (2002)、AICIS IMAP (2016)) (2)ラット(雌)のLD50:1,722 mg/kg(SIAR (2002)、AICIS IMAP (2016)) (3)ウサギ(雄)のLD50:3,550 mg/kg(SIAR (2002)、AICIS IMAP (2016)) (4)ウサギ(雌)のLD50:2,510 mg/kg(SIAR (2002)、AICIS IMAP (2016)) (5)ウサギのLD50:> 3,040 mg/kg(ACGIH (7th, 2001)) (6)ウサギのLD50:2,000~3,160 mg/kg(CERI有害性評価書 (2008)) | |||
| 吸入: ガス | 【分類根拠】 GHSの定義における固体であり、区分に該当しない。 | |||
| 吸入: 蒸気 | 【分類根拠】 データ不足のため分類できない。 | |||
| 吸入: 粉じん及びミスト | 【分類根拠】 (1)より区分に該当しない。なお、新たな知見に基づき分類結果を変更した。 【根拠データ】 (1)ラットのLC50(4時間、粉塵):> 16.1 mg/L(ACGIH (7th, 2001)、SIAR (2002)、AICIS IMAP (2018)、CERI有害性評価書 (2008)) | |||
| 皮膚腐食性及び皮膚刺激性 | 【分類根拠】 (1)、(2)より、区分に該当しない(国連分類基準の区分3)とした。なお、新たな知見に基づき、分類結果を変更した。 【根拠データ】 (1)ウサギ(n= 6)を用いた皮膚刺激性試験(OECD TG 404、GLP、閉塞、24時間適用、8日間観察)において、パッチ除去24及び72時間後の全例の平均スコアは、紅斑ではいずれも0、浮腫では2.17及び1.0であった。48時間値は欠測のため、24時間値と同じと仮定して求めた24/48/72時間の全体の平均スコアは紅斑で0.0、浮腫で1.8であった。本物質は軽微な (slightly) 刺激性を有するとの報告がある(AICIS IMAP (2016)、SIAR (2002)、CERI 有害性評価書 (2008)、REACH登録情報 (Accessed Dec. 2021))。 (2)ウサギ(n= 6)を用いた皮膚刺激性試験(OECD TG 404、GLP、原体500 mg、24時間閉塞、72時間観察)において、無傷皮膚では紅斑はみられず、軽微な浮腫(フルスコア4:2.17/4)、有傷皮膚では軽微な紅斑(0.17/4)と軽微な浮腫(1.67/4)がみられ、72時間後には消失した。皮膚刺激指数は0.1(最高8)と算出され、本物質は軽微な (slightly) 刺激性を有するとの報告がある(AICIS IMAP (2016)、SIAR (2002)、REACH登録情報 (Accessed Dec. 2021))。 | |||
| 眼に対する重篤な損傷性又は眼刺激性 | 【分類根拠】 (1)~(3)より、区分に該当しない。新たな知見に基づき、分類結果を変更した。 【根拠データ】 (1)ウサギ(n= 6)を用いた眼刺激性試験(OECD TG 405相当、8日間観察)では、結膜のみ影響がみられ、平均刺激スコア(フルスコア:110)は24時間後に6/6例で2/110、48時間後に4/6例で2/110、72時間後に2/6例で2/110、8日後に6/6例で0/110となった(SIAR (2002)、AICIS IMAP (2016)、REACH登録情報 (Accessed Dec. 2021))。 (2)ウサギを用いた眼刺激性試験(OECD TG 405相当、72時間観察)において、各時点における刺激指数(フルスコア:110)の最高スコアは6/110であった(REACH登録情報 (Accessed Dec. 2021))。 (3)ウサギ(n= 2)を用いた眼刺激性試験(20秒後に洗浄(1例)又は非洗浄(1例)、4時間観察)において、洗浄眼では1時間後に軽微な角膜混濁がみられたが、4時間後には消失した。非洗浄眼では角膜、虹彩、結膜への影響がみられなかった(SIAR (2002)、AICIS IMAP (2016))。 | |||
| 呼吸器感作性 | 【分類根拠】 データ不足のため分類できない。 | |||
| 皮膚感作性 | 【分類根拠】 データ不足のため分類できない。 【参考データ等】 (1)モルモットを用いたDraize法による皮膚感作性試験(誘導:3%、惹起:0.3%)では陰性であった(SIAR (2002))。 (2)モルモット(n= 10)を用いたDraize変法による皮膚感作性試験(誘導:10%、惹起:10%)では、全例とも陽性反応を示した(SIAR (2002))。 (3)OECDは上記2件のデータの質や情報量の少なさから、感作性の結論を出すことはできないとしている(SIAR (2002))。 | |||
| 生殖細胞変異原性 | 【分類根拠】 (1)、(2)より、区分2とした。 【根拠データ】 (1)In vivoでは、マウスの脳、肝臓、骨髄を標的としたDNA鎖切断試験(単回腹腔内投与、30~100 mg/kg)で陽性、ラットの肝細胞を用いた付加体形成試験(単回強制経口投与、0.5 mmol/kg)で陰性、ラットの骨髄を用いた染色体異常試験(単回強制経口投与、30~300 mg/kg)で陰性、マウスの骨髄を用いた小核試験(単回腹腔内投与、500 mg/kg)で陽性の結果が得られている(IARC 123 (2020)、AICIS IMAP (2016)、CERI有害性評価書 (2008)、SIAR (2002))。 (2)In vitroでは、細菌復帰突然変異試験で陽性又は陰性、ほ乳類培養細胞(CHL、CHO、ヒトリンパ球)を用いた染色体異常試験で陽性又は陰性、マウスリンフォーマ試験で陽性、CHO細胞を用いた遺伝子突然変異試験で陰性の結果が得られている(AICIS IMAP (2016)、CERI有害性評価書 (2008)、SIAR (2002)、安衛法変異原性試験 (Accessed Nov. 2021))。 【参考データ等】 (3)EU CLP (Accessed Nov. 2021) ではMuta. 2に分類されている。 | |||
| 発がん性 | 【分類根拠】 (1)~(5)より、区分1Bとした。 【根拠データ】 (1)国内外の評価機関による既存分類結果として、IARCでグループ2Bに(IARC 123 (2020))、日本産業衛生学会で第2群Bに(産衛学会許容濃度等の勧告 (2020):2015年提案)、ACGIHでA3に(ACGIH (7th, 2001):1995年提案)、EUでCarc. 2に(CLP分類結果 (Accessed Nov. 2021))、DFGでCategory 3に(List of MAK and BAT values 2020 (Accessed Nov. 2021))、それぞれ分類されている。 (2)ラットを用いた用いた2年間混餌投与(40~1,000 ppm)によるがん原性試験において、雌雄とも脾臓の間葉系組織由来の腫瘍(線維腫、線維肉腫、骨肉腫、肉腫(NOS)、血管肉腫)、副腎の褐色細胞腫の発生増加が認められた。腫瘍発生の用量については、脾臓では雄で200ppm以上、雌では1,000ppmであり、副腎では雌雄とも1,000 ppmと報告された(厚労省委託がん原性試験結果 (1991)、MOE初期評価 (2002)、IARC 123 (2020))。 (3)マウスを用いた2年間混餌投与(125~2,000 ppm)によるがん原性試験において、雄に血管腫、悪性リンパ腫及び肝細胞がん、雌に肝臓の血管肉腫と肝細胞がんの発生増加が認められたが、発生率が低値であることから、がん原性は断定できないと報告された(厚労省委託がん原性試験結果 (1991)、MOE初期評価 (2002)、IARC 123 (2020))。 (4)マウスを用いた21ヵ月間混餌投与(3,000、6,000 ppm)による発がん性試験では、雌雄とも6,000 ppmで血管腫瘍の発生増加が認められた。(IARC 123 (2020) 、MOE初期評価 (2002))。 (5)本物質は厚生労働省化学物質による健康障害防止指針(がん原性指針)の対象物質である(令和2年2月7日付け健康障害を防止するための指針公示第 207号)。 【参考データ等】 (6)本物質の発がん性の作用機序に関しては、遺伝毒性、酸化ストレス、細胞増殖/細胞死/栄養供給の変化などが想定されるが、既存知見からはいずれも決定的な強い証拠はなく、中程度の証拠と判断されている(IARC 123 (2020))。 | |||
| 生殖毒性 | 【分類根拠】 (1)、(2)より、母動物に軽微な一般毒性影響がみられる用量で生殖発生影響がみられたことから区分1Bとした。 【根拠データ】 (1)雌ラットを用いた強制経口投与による発生毒性試験(5~45 mg/kg/day、妊娠6~19日)において、母動物に体重増加抑制及び脾臓重量増加がみられた最高用量(45 mg/kg/day)で吸収胚数の増加、胎児に骨格異常(湾曲肋骨、前肢の歪曲)の頻度増加がみられたとの報告がある(SIAR (2002)、CERI有害性評価書(2008)、AICIS IMAP (2016))。 (2)マウスを用いた強制経口投与による連続交配試験(62.5~250 mg/kg/day、交配前7日間及び交配期間98日間)において、F0親動物に摂水量の減少、F1親動物にチアノーゼ、肝臓の絶対・相対重量増加、脾臓の腫大及び暗色化がみられる最高用量(250 mg/kg/day)でF0親動物の2回目以降の交配による受胎率の低下が認められた。F1、F2児動物には同腹児数の減少傾向、体重の低値がみられたとの報告がある(SIAR (2002)、CERI有害性評価書(2008)、AICIS IMAP (2016))。 【参考データ等】 (3)ラットを用いた強制経口投与による2世代生殖毒性試験(0.1~5 mg/kg/day、交配14週間前から哺育期間中)において、F0親動物に明確な一般毒性がみられない最高用量(5 mg/kg/day)で妊娠率及び雄の受胎率にわずかな減少がみられたが、F1では同様の影響は再現されず、5 mg/kg/dayまで生殖能への有害影響はないと判断された。F1については、成長後に0.1 mg/kg/day以上で脾臓への影響(髄外造血亢進、褐色細胞を含んだ網内皮細胞)がみられたが、生殖影響はみられなかったとの報告がある(SIAR (2002)、CERI有害性評価書(2008)、AICIS IMAP (2016))。 (4)雌ウサギを用いた強制経口投与による発生毒性試験(5~40 mg/kg/day、妊娠7~19日)において、最高用量では母動物に過剰毒性(死亡:8/18例)が発現し影響評価から除外された。中用量(15 mg/kg/day)以下では投与に関連した影響はみられなかったとの報告がある(SIAR (2002)、CERI有害性評価書(2008)、AICIS IMAP (2016))。 | |||
| 特定標的臓器毒性 (単回ばく露) | 【分類根拠】 (1)~(3)より区分1(血液系)とした。また、(4)の各臓器の病理組織所見は本物質の血液系影響(溶血性貧血)に伴う二次的影響と判断した。 【根拠データ】 (1)ヒトの急性中毒症状としては、メトヘモグロビン血症、嘔吐、頭痛のほか、極めて重篤な症例では虚脱がみられるとの報告がある(SIAR (2002))。 (2)ヒトに対する本物質の急性毒性はメトヘモグロビン形成に起因する溶血性貧血のほか、悪心、嘔吐、頭痛などの自覚症状が発現する。中毒事例では頭重、頭痛、食欲不振、悪心、めまい、息苦しさ等を自覚症状とし、重篤なチアノーゼが認められ、メトヘモグロビン濃度の著しい上昇がみられたとの報告がある(CERI有害性評価書 (2008))。 (3)実験動物に対する毒性症状としては、チアノーゼ、血尿、呼吸障害がみられるとの報告がある(CERI有害性評価書 (2008))。 (4)ラット及びマウスの単回経口投与試験における生存例の病理組織所見として、ラットでは脾臓のうっ血、脾臓・肝臓・腎臓・骨髄のヘモジデリン沈着、骨髄の赤血球造血亢進、マウスでは脾臓の髄外造血の程度の増強・うっ血、脾臓・肝臓・骨髄のヘモジデリン沈着がみられたとの報告がある(厚労省委託がん原性試験結果 (1991))。 | |||
| 特定標的臓器毒性 (反復ばく露) | 【分類根拠】 (1)の症例報告、(2)~(7)の区分1の用量範囲において、血液系影響(溶血性貧血)がみられることから区分1(血液系)とした。なお、脾臓、肝臓、腎臓、骨髄への影響は血液系影響による二次的影響と考え分類に採用しなかった。 【根拠データ】 (1)本物質に吸入ばく露された作業者でチアノーゼが認められた症例報告がある。これらの症例では血中ヘモグロビン濃度の低下がみられている(AICIS IMAP (2016)、DFG MAK (1992))。 (2)ラットを用いた強制経口投与による90日間反復経口投与試験において、3及び10 mg/kg/day以上(区分1の範囲)で血液影響(メトヘモグロビン濃度の上昇、赤血球数・ヘモグロビン・ヘマトクリット値の減少)、肝臓、腎臓のヘモジデリン沈着及び肝臓の髄外造血、30mg/kg/day(区分2の範囲)で雄に骨髄の過形成と精巣萎縮がみられたとの報告がある(CERI有害性評価書 (2008)、SIAR (2002)、AICIS IMAP (2016))。 (3)ラットを用いた強制経口投与による2年間慢性毒性/がん原性併合試験において、0.7及び5 mg/kg/day(区分1の範囲)で血液影響(軽度貧血、血中メトヘモグロビン濃度の上昇)がみられたとの報告がある(CERI有害性評価書 (2008)、SIAR (2002))。 (4)ラット及びマウスを用いた混餌投与による2年間慢性毒性/がん原性併合試験において、ラットでは200 ppm(10 mg/kg/day、区分1の範囲)で血液影響(貧血を示唆する赤血球パラメータの変化、血小板数増加)、脾臓影響(うっ血、髄外造血等)、1,000 ppm(50 mg/kg/day、区分2の範囲)で脾臓の線維化、骨髄の造血亢進、雌に副腎(皮質・髄質)の過形成等がみられた。マウスでは500 ppm(75 mg/kg/day、区分2の範囲)でラットと同様の血液影響に加え、肺の病変(細気管支上皮の増生、肺胞壁肥厚)がみられたとの報告がある(厚労省委託がん原性試験結果 (1991))。 (5)マウスを用いた13週間反復吸入ばく露試験(6時間/日、5日/週)において、12及び24 ppm(ガイダンス値換算:0.057及び0.11mg/L、区分2の範囲)で脾臓影響(造血細胞の増殖、色素沈着)、肝臓重量増加、前胃の扁平上皮の過形成(雌)がみられたとの報告がある(CERI有害性評価書 (2008)、SIAR (2002) 、AICIS IMAP (2016))。 (6)ラットを用いた4週間反復吸入ばく露試験(6時間/日、5日/週)において0.9~7 ppm(ガイダンス値換算:0.001~0.01 m/L、区分1の範囲)で血液影響(チアノーゼ、赤血球パラメータの減少、メトヘモグロビン濃度の上昇、白血球数増加)、脾臓影響(重量増加・腫大・うっ血・髄外造血及びヘモジデリン沈着)がみられたとの報告がある(CERI有害性評価書 (2008)、SIAR (2002) 、AICIS IMAP (2016))。 (7)ラットを用いた13週間反復吸入ばく露(試験(6時間/日、5日/週)において、1.5 ppm以上(ガイダンス値換算:0.007 mg/L、区分1の範囲)でメトヘモグロビン濃度の上昇、6~24 ppm(ガイダンス値換算:0.028~0.11 mg/L、区分2の範囲)で脾臓影響(腫大、造血亢進)、腎臓近位尿細管への影響がみられたとの報告がある(CERI有害性評価書 (2008)、SIAR (2002) 、AICIS IMAP (2016))。 | |||
| 誤えん有害性* | 【分類根拠】 データ不足のため分類できない。 | |||
| * JIS Z7252の改訂により吸引性呼吸器有害性から項目名が変更となった。 | ||||
| 12.環境影響情報 | |||
|---|---|---|---|
| 生態毒性 | |||
| 水生環境有害性 短期(急性) | 甲殻類(コウライエビ)の96時間LC50 = 2.14 mg/L(NITE初期リスク評価書, 2005)から、区分2とした。 | ||
| 水生環境有害性 長期(慢性) | 急性毒性区分2であり、急速分解性がない(BODによる分解度:0%(既存点検, 1976))ことから、区分2とした。 | ||
| 残留性・分解性 | 化審法分解度試験:難分解性(化学物質安全性点検結果等(分解性・蓄積性)) | ||
| 生態蓄積性 | 化審法濃縮度試験:低濃縮性(化学物質安全性点検結果等(分解性・蓄積性)) | ||
| 土壌中の移動性 | 情報なし | ||
| オゾン層への有害性 | 当該物質はモントリオール議定書の附属書に列記されていない。 | ||
| 13.廃棄上の注意 | |||
|---|---|---|---|
| 化学品(残余廃棄物)、当該化学品が付着している汚染容器及び包装の安全で、かつ、環境上望ましい廃棄、又はリサイクルに関する情報 | 廃棄においては、関連法規ならびに地方自治体の基準に従うこと。 都道府県知事などの許可を受けた産業廃棄物処理業者、もしくは地方公共団体がその処理を行っている場合にはそこに委託して処理する。 廃棄物の処理を委託する場合、処理業者等に危険性、有害性を十分告知の上処理を委託する。 | ||
| 容器は洗浄してリサイクルするか、関連法規制並びに地方自治体の基準に従って適切な処分を行う。 空容器を廃棄する場合は、内容物を完全に除去すること。 | |||
| 14.輸送上の注意 | ||||
|---|---|---|---|---|
| 本物質のGHS分類結果に基づく国際規制の分類等は、以下の通りと推定されるが、該否は製品によって異なる場合がある。輸送危険物の分類は、容器等級を含め、荷送人が責任をもって判断することとされているため、輸送の際には、個々の貨物について、製品の状態、形状等も考慮し、輸送モード (航空、船舶) を規制する法規に沿って事業者が判断する必要がある。 | ||||
| 国際規制 | ||||
| 国連番号 | 1578 | |||
| 品名(国連輸送名) | クロロニトロベンゼン(固体) | |||
| 国連分類 | 6.1 | |||
| 副次危険 | - | |||
| 容器等級 | Ⅱ | |||
| 海洋汚染物質 | 該当する | |||
| MARPOL73/78附属書Ⅱ及びIBCコードによるばら積み輸送される液体物質 | 該当しない | |||
| 国内規制 | ||||
| 海上規制情報 | 船舶安全法の規定に従う。 | |||
| 航空規制情報 | 航空法の規定に従う。 | |||
| 陸上規制情報 | 道路法、毒物及び劇物取締法の規定に従う。 | |||
| 特別な安全上の対策 | 道路法、毒物及び劇物取締法の規定によるイエローカード携行の対象物 | |||
| その他 (一般的) 注意 | 輸送に際しては、直射日光を避け、容器の破損、腐食、漏れのないように積み込み、荷崩れの防止を確実に行う。 重量物を上積みしない。 | |||
| 緊急時応急措置指針番号* | 152 | |||
| * 北米緊急時応急措置指針に基づく。米国運輸省が中心となって発行した「2020 Emengency Response Guidebook (ERG 2020)」(一般社団法人日本化学工業協会によって和訳されている(発行元:日本規格協会)に掲載されている。 | ||||
| 15.適用法令 | ||||
|---|---|---|---|---|
| 法規制情報は作成年月日時点に基づいて記載されております。事業場において記載するに当たっては、最新情報を確認してください。 | ||||
| 労働安全衛生法 | 特定化学物質第2類物質、特定第2類物質(特定化学物質障害予防規則第2条第1項第2、3号 名称等を表示すべき危険物及び有害物(法第57条第1項、施行令第18条第1号、第2号別表第9) 名称等を通知すべき危険物及び有害物(法第57条の2、施行令第18条の2第1号、第2号別表第9) 危険性又は有害性等を調査すべき物(法第57条の3) 変異原性が認められた既存化学物質(法第57条の5、労働基準局長通達) 健康障害防止指針公表物質(法第28条第3項) 作業環境評価基準(法第65条の2第1項) | |||
| 労働基準法 | 疾病化学物質(法第75条第2項、施行規則第35条別表第1の2第4号1) | |||
| 化審法 | 優先評価化学物質(法第2条第5項) | |||
| 化学物質排出把握管理促進法(PRTR法) | 第一種指定化学物質(法第2条第2項、施行令第1条別表第1) | |||
| 毒物及び劇物取締法 | 劇物(指定令第2条) | |||
| 大気汚染防止法 | 有害大気汚染物質に該当する可能性がある物質(中央環境審議会第9次答申) | |||
| 船舶安全法 | 毒物類(危規則第3条危険物告示別表第1) | |||
| 航空法 | 毒物類(施行規則第194条危険物告示別表第1) | |||
| 港則法 | その他の危険物・毒物類(毒物)(法第20条第2項、規則第12条、危険物の種類を定める告示別表) | |||
| 16.その他の情報 | ||||
|---|---|---|---|---|
| 参考文献 | ||||
| 9項、11項については各データ毎に記載。その他の各項については以下を参照。 ・NITE化学物質総合情報提供システム(NITE-CHRIP) ・International Chemical Safety Cards (ICSC) ・Hazardous Substances Data Bank (HSDB) ・GESTIS Substance database (GESTIS) ・ERG 2020版 緊急時応急措置指針-容器イエローカードへの適用 ・一般社団法人日本化学工業協会 編「GHS対応ガイドライン ラベル及び表示・安全デ-タシ-ト作成指針」 | ||||