| 1.化学物質等及び会社情報 | |||
|---|---|---|---|
| 化学物質等の名称 | シクロホスファミド無水物、(Cyclophosphamide anhydride) | ||
| 製品コード | 21A3731 | ||
| 会社名 | ○○○○株式会社 | ||
| 住所 | 東京都△△区△△町△丁目△△番地 | ||
| 電話番号 | 03-1234-5678 | ||
| 緊急時の電話番号 | 03-1234-5678 | ||
| FAX番号 | 03-1234-5678 | ||
| メールアドレス | |||
| 推奨用途及び使用上の制限 | 抗悪性腫瘍薬、副腎皮質ステロイド及びビンクリスチンとの併用でホジキン病と非ホジキンリンパ腫の治療、小児の慢性リンパ球性白血病、慢性顆粒球白血病、急性骨髄性、単芽球性白血病及び急性リンパ芽球白血病、多発性骨髄腫、菌状息肉腫、神経芽細胞腫、卵巣腺癌、網膜芽腫、乳癌及び特定の肺がん。 | ||
| 2.危険有害性の要約 | |||
|---|---|---|---|
| GHS分類 | |||
| 分類実施日 | H22.3.16、政府向けGHS分類ガイダンス(H21.3版)を使用 | ||
| 物理化学的危険性 | 火薬類 | 分類対象外 |
|---|---|---|
| 引火性・可燃性ガス | 分類対象外 | |
| 引火性エアゾール | 分類対象外 | |
| 酸化性ガス類 | 分類対象外 | |
| 高圧ガス | 分類対象外 | |
| 引火性液体 | 分類対象外 | |
| 可燃性固体 | 分類できない | |
| 自己反応性化学品 | 分類対象外 | |
| 自然発火性液体 | 分類対象外 | |
| 自然発火性固体 | 分類できない | |
| 自己発熱性化学品 | 分類できない | |
| 水反応可燃性物質 | 区分外 | |
| 酸化性液体 | 分類対象外 | |
| 酸化性固体 | 分類できない | |
| 有機過酸化物 | 分類対象外 | |
| 金属腐食性物質 | 分類できない | |
| 健康に対する有害性 | 急性毒性(経口) | 区分3 |
| 急性毒性(経皮) | 分類できない | |
| 急性毒性(吸入:ガス) | 分類対象外 | |
| 急性毒性(吸入:蒸気) | 分類できない | |
| 急性毒性(吸入:粉じん) | 分類できない | |
| 急性毒性(吸入:ミスト) | 分類対象外 | |
| 皮膚腐食性・刺激性 | 分類できない | |
| 眼に対する重篤な損傷性・刺激性 | 分類できない | |
| 呼吸器感作性 | 分類できない | |
| 皮膚感作性 | 分類できない | |
| 生殖細胞変異原性 | 区分1B | |
| 発がん性 | 区分1A | |
| 生殖毒性 | 区分1A授乳に対するまたは授乳を介した影響 | |
| 特定標的臓器毒性(単回ばく露) | 区分1(骨髄) | |
| 特定標的臓器毒性(反復ばく露) | 区分1(骨髄、心臓、肝臓、免疫系、全身毒性) | |
| 吸引性呼吸器有害性 | 分類できない | |
| 環境に対する有害性 | 水生環境急性有害性 | 分類できない |
| 水生環境慢性有害性 | 分類できない |
| ラベル要素 | |||
|---|---|---|---|
| 絵表示又はシンボル |   | ||
| 注意喚起語 | 危険 | ||
| 危険有害性情報 | 飲み込むと有毒 | ||
| 遺伝疾患のおそれ | |||
| 発がんのおそれ | |||
| 生殖能または胎児への悪影響のおそれ(奇形) | |||
| 授乳中に子に害を及ぼすおそれ | |||
| 骨髄の障害 | |||
| 長期にわたるまたは反復ばく露による骨髄、心臓、肝臓、免疫系の障害、全身毒性 | |||
| 注意書き | |||
| 【安全対策】 | |||
| 取扱後は手をよく洗うこと。 | |||
| この製品を使用する時に、飲食または喫煙をしないこと。 | |||
| 使用前に取扱説明書を入手すること。 | |||
| 全ての安全注意を読み理解するまで取り扱わないこと。 | |||
| 適切な個人用保護具を使用すること。 | |||
| 妊娠中、授乳期中は接触を避けること。 | |||
| 粉じん、ヒューム、蒸気、スプレーを吸入しないこと。 | |||
| 【応急措置】 | |||
| 飲み込んだ場合:直ちに医師に連絡すること。 | |||
| 飲み込んだ場合、口をすすぐこと。 | |||
| ばく露またはばく露の懸念がある場合:医師の診断、手当てを受けること。 | |||
| ばく露した場合:医師に連絡すること。 | |||
| 気分が悪い時は、医師の診断、手当てを受けること。 | |||
| 【保管】 | |||
| 施錠して保管すること。 | |||
| 【廃棄】 | |||
| 内容物、容器を都道府県知事の許可を受けた専門の廃棄物処理業者に委託すること。 | |||
| 国・地域情報 | |||
| 3.組成及び成分情報 | |||
|---|---|---|---|
| 化学物質 | |||
| 化学名又は一般名 | シクロホスファミド無水物 | ||
| 別名 | シクロホスファミド (Cyclophosphamide)、2‐[ビス(2‐クロロエチル)アミノ]テトラヒドロ‐2H‐1,3,2‐オキサザホスホリン 2‐オキシド、(2-[Bis(2-chloroethyl)amino]tetrahydro-2H-1,3,2-oxazaphosphorin 2-oxide)、エンドキサン、(Endoxane) | ||
| 分子式 (分子量) | C7H15Cl2N2O2P(261.089) | ||
| 化学特性 (示性式又は構造式) | 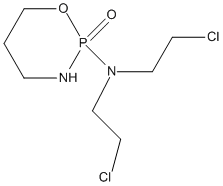 | ||
| CAS番号 | 50-18-0 | ||
| 官報公示整理番号(化審法・安衛法) | 局方 | ||
| 分類に寄与する不純物及び安定化添加物 | データなし | ||
| 濃度又は濃度範囲 | 100% | ||
| 4.応急措置 | |||
|---|---|---|---|
| 吸入した場合 | 気分が悪い時は、医師の診断、手当てを受けること。 | ||
| 皮膚に付着した場合 | 水と石鹸で洗うこと。 | ||
| 皮膚刺激が生じた場合、医師の診断、手当てを受けること。 | |||
| 目に入った場合 | 水で数分間注意深く洗うこと。 | ||
| 眼の刺激が持続する場合は、医師の診断、手当てを受けること。 | |||
| 飲み込んだ場合 | 直ちに医師に連絡すること。 | ||
| 口をすすぐこと。 | |||
| 予想される急性症状及び遅発性症状 | 吸入 : 「経口摂取」参照。 | ||
| 皮膚 : 発赤、痛み。 | |||
| 眼 : 発赤、痛み。 | |||
| 経口摂取 : 下痢、めまい、頭痛、吐き気、嘔吐。 | |||
| 最も重要な兆候及び症状 | データなし | ||
| 応急措置をする者の保護 | データなし | ||
| 医師に対する特別注意事項 | ばく露の程度によっては、定期検診を勧める。 作業衣を家に持ち帰ってはならない。 | ||
| 5.火災時の措置 | |||
|---|---|---|---|
| 消火剤 | 水噴霧、泡消火剤、粉末消火剤、炭酸ガス、乾燥砂類 | ||
| 使ってはならない消火剤 | 棒状放水 | ||
| 特有の危険有害性 | 熱、火花及び火炎で発火するおそれがある。 | ||
| 激しく加熱すると燃焼する。 | |||
| 火災時に刺激性、腐食性及び毒性のガスを発生するおそれがある。 | |||
| 特有の消火方法 | 危険でなければ火災区域から容器を移動する。 | ||
| 安全に対処できるならば着火源を除去すること。 | |||
| 消火を行う者の保護 | 適切な空気呼吸器、防護服(耐熱性)を着用する。 | ||
| 6.漏出時の措置 | |||
|---|---|---|---|
| 人体に対する注意事項、保護具および緊急措置 | 全ての着火源を取り除く。 | ||
| 直ちに、全ての方向に適切な距離を漏洩区域として隔離する。 | |||
| 関係者以外の立入りを禁止する。 | |||
| 密閉された場所に立入る前に換気する。 | |||
| 環境に対する注意事項 | 環境中に放出してはならない。 | ||
| 回収・中和 | 漏洩物を掃き集めて空容器に回収し、後で廃棄処理する。 | ||
| 封じ込め及び浄化方法・機材 | 水で湿らせ、空気中のダストを減らし分散を防ぐ。 | ||
| 二次災害の防止策 | すべての発火源を速やかに取除く(近傍での喫煙、火花や火炎の禁止)。 | ||
| プラスチックシートで覆いをし、散乱を防ぐ。 | |||
| 7.取扱い及び保管上の注意 | |||
|---|---|---|---|
| 取扱い | |||
| 技術的対策 | 『8.ばく露防止及び保護措置』に記載の設備対策を行い、保護具を着用する。 | ||
| 局所排気・全体換気 | 『8.ばく露防止及び保護措置』に記載の局所排気、全体換気を行う。 | ||
| 安全取扱い注意事項 | 取扱後は手をよく洗うこと。 | ||
| この製品を使用する時に、飲食または喫煙をしないこと。 | |||
| 使用前に取扱説明書を入手すること。 | |||
| 全ての安全注意を読み理解するまで取り扱わないこと。 | |||
| 適切な個人用保護具を使用すること。 | |||
| 妊娠中、授乳期中は接触を避けること。 | |||
| 粉じん、ヒューム、蒸気、スプレーを吸入しないこと。 | |||
| 接触回避 | 『10.安定性及び反応性』を参照。 | ||
| 保管 | |||
| 技術的対策 | 特別に技術的対策は必要としない。 | ||
| 混触危険物質 | 『10.安定性及び反応性』を参照。 | ||
| 保管条件 | 施錠して保管すること。 | ||
| 容器包装材料 | データなし | ||
| 8.ばく露防止及び保護措置 | |||
|---|---|---|---|
| 管理濃度 | 未設定(2009年度) | ||
| 許容濃度 (ばく露限界値、生物学的ばく露指標) | |||
| 日本産衛学会 | 未設定(2009年度) | ||
| ACGIH | 未設定(2009年度) | ||
| 設備対策 | この物質を貯蔵ないし取扱う作業場には洗眼器と安全シャワーを設置すること。 | ||
| ばく露を防止するため、装置の密閉化又は局所排気装置を設置すること。 | |||
| 保護具 | |||
| 呼吸器の保護具 | 適切な呼吸器保護具を着用すること。 | ||
| 手の保護具 | 適切な保護手袋を着用すること。 | ||
| 眼の保護具 | 適切な眼の保護具を着用すること。 | ||
| 皮膚及び身体の保護具 | 適切な保護衣を着用すること。 | ||
| 衛生対策 | 取扱い後はよく手を洗うこと。 | ||
| 9.物理的及び化学的性質 | |||
|---|---|---|---|
| 物理的状態 | |||
| 形状 | 固体 | ||
| 色 | データなし | ||
| 臭い | 無臭 | ||
| pH | 3.9-7.1 (1 in 100) : IARC vol.26 (1981) | ||
| 融点・凝固点 | 43 ℃ : Lide (88th, 2008) /データなし | ||
| 沸点、初留点及び沸騰範囲 | データなし | ||
| 引火点 | 112 ℃ (CC) : SITTIG (5th, 2008) | ||
| 自然発火温度 | データなし | ||
| 燃焼性(固体、ガス) | データなし | ||
| 爆発範囲 | データなし | ||
| 蒸気圧 | 0.0000445 mmHg (25 ℃ est) : SRC (2009) | ||
| 蒸気密度 | データなし | ||
| 蒸発速度(酢酸ブチル=1) | データなし | ||
| 比重(密度) | データなし、(データなし) | ||
| 溶解度 | 4.00E+004 mg/L (20 ℃ exp) : Howard (1997) | ||
| ベンゼン、四塩化炭素に難溶、エタノール、アセトンに非常に難溶 : HSDB (2009) | |||
| オクタノール・水分配係数 | log Kow = 0.63 (exp) : Howard (1997) | ||
| 分解温度 | データなし | ||
| 粘度 | データなし | ||
| 粉じん爆発下限濃度 | データなし | ||
| 最小発火エネルギー | データなし | ||
| 体積抵抗率(導電率) | データなし | ||
| 10.安定性及び反応性 | |||
|---|---|---|---|
| 安定性 | 法規制に従った保管及び取扱においては安定と考えられる | ||
| 危険有害反応可能性 | 燃焼すると分解し、有毒なヒューム(リン酸化物、窒素酸化物など)を生じる。 | ||
| 避けるべき条件 | 燃焼 | ||
| 混触危険物質 | データなし | ||
| 危険有害な分解生成物 | 有毒なヒューム(リン酸化物、窒素酸化物など) | ||
| 11.有害性情報 | |||
|---|---|---|---|
| 急性毒性 | |||
| 経口 | ラットLD50値は180 mg/kg(IARC 26 (1981))であるとの報告に基づき、区分3とした。 | ||
| 経皮 | データなし。 | ||
| 吸入 | 吸入(ガス): | GHS定義における固体である。 | |
| 吸入(蒸気): | データなし。 | ||
| 吸入(粉じん、ミスト): | データなし。 | ||
| 皮膚腐食性・刺激性 | データ不足で分類できない。 なお、本剤は皮膚を刺激するとの記述(SITTIG (5th, 2008))があるが詳細は不明である。 | ||
| 眼に対する重篤な損傷・刺激性 | データ不足で分類できない。なお本剤は眼を刺激し、重度の損傷を起こす可能性があるとの記述(SITTIG (5th, 2008))があるが詳細は不明である。 | ||
| 呼吸器感作性又は皮膚感作性 | 呼吸器感作性:データなし。 | ||
| 皮膚感作性:データなし。 | |||
| 生殖細胞変異原性 | マウス及びラットを用いた優性致死試験(生殖細胞in vivo経世代変異原性試験)で陽性の報告(IARC vol.26 (1981))に基づき区分1Bとした。なお、チャイニーズハムスター及びマウスの精原細胞を用いた染色体異常試験(生殖細胞in vivo変異原性試験)で陽性の報告(IARC vol.26 (1981))、マウス及びラットを用いた骨髄細胞及び末梢血を用いた小核試験(体細胞in vivo変異原性試験)で陽性の報告(NTP DB (Access on Oct. 2009))がある。また、シクロホスファミドによる治療を受けた非悪性疾患の小児及び慢性関節リウマチ患者の末梢血リンパ球、再発性卵巣及び子宮がん患者にシクロホスファミドを静脈内投与後3~24時間後のリンパ球、リンパ肉芽腫症患者にシクロホスファミドを投与後24~72時間後の骨髄及びリンパ節細胞において、いずれも染色体異常数の増加が報告されている(IARC 26 (1981))。 | ||
| 発がん性 | IARCでGroup 1に分類されている(IARC 100A (2008))ことから、区分1Aに分類した。 なお、当該薬物の治療により、非悪性疾患の患者では少なくとも30例の悪性腫瘍(非リンパ性白血病、膀胱がん等)が報告され、さらに悪性腫瘍の患者では83例の二次悪性腫瘍(非リンパ性白血病、膀胱がん等)の報告(IARC 26 (1981))がある。また、ラットの生涯にわたり経口投与した試験でも、ヒトと同様に膀胱に対する臓器特異的な影響が見られ、膀胱がんの発生が報告されている(IARC 26 (1981))。 | ||
| 生殖毒性 | シクロホスファミドは男女の生殖細胞に損傷を与え、不妊症を引き起こすとの報告(IARC 26 (1981))、また妊娠中に本剤による治療を受けた女性からの出生児に母指、または中手骨および指節骨の欠損、口蓋裂、冠動脈欠損、眼及び耳の奇形、および多発奇形が報告されている(IARC 26 (1981)、Birth Defects (3rd, 2000))ことから、区分1Aとした。また、乳汁中に分泌されていることが報告されているとの記載(医療用医薬品集 (2010))があることから、授乳に対するまたは授乳を介した影響に関する追加区分とした。なお、実験動物ではシクロホスファミドはマウス、ラット、ウサギなどいくつかの動物種で催奇形性が見られる(IARC 26 (1981))と記述されている。事実、ラット又はマウスを用いた試験(IARC vol.26 (1981))で出生仔に眼の異常及び骨格欠損(手足、指)等種々の奇形(IARC vol.26 (1981)、Birth Defects (3rd, 2000))、ウサギを用いた試験では出生仔に口蓋裂及び顎欠損(Birth Defects (3rd, 2000))がそれぞれ報告されている。 | ||
| 特定標的臓器・全身毒性(単回ばく露) | 本物質は抗腫瘍剤であり、重大な副作用として骨髄抑制(白血球減少、血小板減少などを起こす)の記載がある(医療用医薬品集(2010))ことから区分1(骨髄)とした。なお、マウス、ラットおよびイヌを用いた試験では白血球減少、血小板低下が報告されている(IARC 26 (1981))。 | ||
| 特定標的臓器・全身毒性(反復ばく露) | 本物質は抗悪性腫瘍剤であり、重大な副作用として骨髄抑制(汎血球減少、貧血、血小板減少、出血などを起こす)の記載(医療用医薬品集(2010))があり、さらに、心筋障害、心不全が0.1~0.5%未満の頻度で発現するとの記載(医療用医薬品集(2010))に基づき、区分1(骨髄、心臓)とした。一方、重大な副作用として頻度不明ながら肝機能障害、黄疸が記載されている(医療用医薬品集(2010))ことから、区分1(肝臓)とした。その他に本物質投与により、頻度不明ながらアナフィラキシー様症状、出血性膀胱炎、皮膚粘膜眼症候群(Stevens-Johnson症候群)など、また、0.1~0.5%未満の頻度でイレウス、胃腸出血、間質性肺炎などが報告されている(医療用医薬品集(2010))が、これらの副作用症状には免疫系への関与が考えられ、あるいは標的臓器の特定が困難なため、区分1(免疫系、全身毒性)とした。以上より分類は区分1(骨髄、心臓、肝臓、免疫系、全身毒性)となる。 | ||
| 吸引性呼吸器有害性 | データなし。 | ||
| 12.環境影響情報 | |||
|---|---|---|---|
| 水生環境急性有害性 | データなし | ||
| 水生環境慢性有害性 | データなし | ||
| 13.廃棄上の注意 | |||
|---|---|---|---|
| 残余廃棄物 | 廃棄の前に、可能な限り無害化、安定化及び中和等の処理を行って危険有害性のレベルを低い状態にする。 | ||
| 廃棄においては、関連法規並びに地方自治体の基準に従うこと。 | |||
| 汚染容器及び包装 | 容器は清浄にしてリサイクルするか、関連法規並びに地方自治体の基準に従って適切な処分を行う。 | ||
| 空容器を廃棄する場合は、内容物を完全に除去すること。 | |||
| 14.輸送上の注意 | |||
|---|---|---|---|
| 国際規制 | |||
| 海上規制情報 | IMOの規定に従う。 | ||
| UN No. | 3249 | ||
| Proper Shipping Name. | MEDICINE, SOLID, TOXIC, N.O.S. | ||
| Class | 6.1 | ||
| Packing Group | Ⅲ | ||
| Marine Pollutant | Not Applicable | ||
| 航空規制情報 | ICAO・IATAの規定に従う。 | ||
| UN No. | 3249 | ||
| Proper Shipping Name. | Medicine, solid, toxic, n.o.s. | ||
| Class | 6.1 | ||
| Packing Group | Ⅲ | ||
| 国内規制 | |||
| 陸上規制情報 | 該当しない | ||
| 海上規制情報 | 船舶安全法の規定に従う。 | ||
| 国連番号 | 3249 | ||
| 品名 | 医薬品(固体) | ||
| クラス | 6.1 | ||
| 容器等級 | Ⅲ | ||
| 海洋汚染物質 | 非該当 | ||
| 航空規制情報 | 航空法の規定に従う。 | ||
| 国連番号 | 3249 | ||
| 品名 | 医薬品(固体)(毒性のもの) | ||
| クラス | 6.1 | ||
| 等級 | 3 | ||
| 特別安全対策 | 移送時にイエローカードの保持が必要。 | ||
| 食品や飼料と一緒に輸送してはならない。 | |||
| 輸送に際しては、直射日光を避け、容器の破損、腐食、漏れのないように積み込み、荷崩れの防止を確実に行う。 | |||
| 重量物を上積みしない。 | |||
| 緊急時応急措置指針番号 | 151 | ||
| 15.適用法令 | |||
|---|---|---|---|
| 船舶安全法 | 毒物類・毒物(危規則第3条危険物告示別表第1) 医薬品(固体) | ||
| 航空法 | 毒物類・毒物(施行規則第194条危険物告示別表第1) 医薬品(固体)(毒性のもの) | ||
| 16.その他の情報 | |||
|---|---|---|---|
| 参考文献 | 各データ毎に記載した。 | ||